
科目: 来源: 题型:
为探究浓硫酸的性质,设计如图装置。检查好气密性后。向烧瓶中加入过量铁粉、碳粉,再滴加浓硫酸。
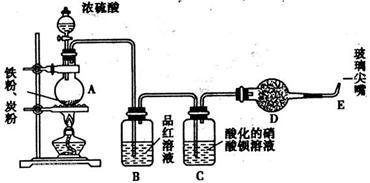
(1)在未点燃酒精灯前,B中无明显现象,这是因为:
。
(2)加热后,在C处的现象是: 。
在E处点燃时需先验纯,其操作方法是:
。
反应一段时间后降至室温,重新加入品红溶液,发现铁粉继续溶解,之后有气体生成。品红不褪色。写出可能发生的两个反应的离子方程式:
,
。
(3)反应结束后,安装好过滤装置。先用热水通过过滤器。以提高其温度,再将烧瓶中的溶液趁热过滤。将滤液转移到试管中,用胶塞塞住管口,静置、冷却。析出硫酸亚铁晶体2.69g。将全部晶体转入硬质玻璃管,高温加热至质量不变,生成SO2 0.112L (已换算为标准状况)。
已知:2FeSO4![]() XH2O
XH2O![]() Fe2O3+SO2↑+SO3↑+2xH2O
Fe2O3+SO2↑+SO3↑+2xH2O
①提高过滤器温度的目的是
②胶塞塞住管口的目的是
③求该晶体中所含结晶水的个数:x= 。
查看答案和解析>>
科目: 来源: 题型:
化合物A、B均是分子式为C8H8O3的无色液体,均难溶于水。从A、B开始,可发生图示的一系列反应(反应中的无机物已全部略去),E的苯环上的一氯代物只有两种。
H、G均可发生银镜反应。
已知:![]()
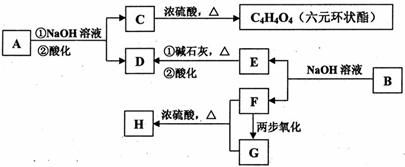
(1)写出结构简式A B 。
(2)H和G中含有相同的官能团,该官能团的名称 。
(3)写出C→C4H4O4反应的化学方程式:
。
(4)D的溶液与过量浓溴水反应的化学方程式为:
。
(5)化学式仍为C8H8O3,能发生银镜反应,且苯环上的一氯代物仅有一种的所有同分异
构体的结构简式:
,
(6)F与氧气构成燃料电池的两极,用稀硫酸溶液做电解质溶液。请写出负极的电极方程 式:
。
查看答案和解析>>
科目: 来源: 题型:
下图中所有物质均为中学化学常见物质,F、H是气体单质,Z是固体金属单质,Y中阳离子与阴离子个数比为2:1,化合物X、Y、A、D、E、G的焰色反应为黄色。I是白色沉淀。C常温呈液态。

(1)写出对应物质的化学式。
X E G I 。
(2)写出Y的电子式: 。
(3)在A的溶液中不断通入气体F,溶液的PH应 。(填增大、减小或不变)
(4)写出B和Y反应的化学方程式: 。
写出E和Z反应的化学方程式: 。
(5)X和G的溶液能否反应?如能反应,写出反应的离子方程式;如不能反应,请说明理由。 。
查看答案和解析>>
科目: 来源: 题型:
我国多次成功发射了“神舟”载人飞船,为我国的航天事业写下了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温,为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂利的性质最可能的是(选填序号) ;
①在高温下不融化 ②在高温下可分解气化
③有强氧化性 ④见光易分解
(2)火箭用的燃料是液态的偏二甲肼和四氧化二氮,已知偏二甲肼含C、H、N三种元素,其中C、N两元素的质量分数分别为40.00%和46.67%,在相同状况下偏二甲肼的密度是H2的30倍,则偏二甲肼的分子式为 ;
(3)若0.1mol液态的偏二甲肼与液态N2O4完全反应,生成气态的N2、H20和CO2,同时放出![]() kJ热量,该反应的氧化剂是 (填化学式);
kJ热量,该反应的氧化剂是 (填化学式);
试写出该反应的热化学方程式:
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是:
(4)假如用液态的偏二甲肼和液态氧作为燃料,那么该燃烧反应的化学方程式为:
;
(5)通常情况下N2O4气体和NO2气体可相互转化;N2O4(g)I(无色)![]() 2NO2(g) (红棕色)
2NO2(g) (红棕色)![]() 。下列说法错误的是(选填序号) 。
。下列说法错误的是(选填序号) 。
①N2O4和NO2互为同素异形体
②若反应在恒容的密闭容器中进行,升温时平衡混合气体颜色加深
③鉴别NO2气体和溴蒸汽可选用硝酸银溶液
④N2O4和NO2都是硝酸的酸酐
查看答案和解析>>
科目: 来源: 题型:
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4 mol/L的稀硝酸,恰好使混合物 完全溶解。放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21 mol C.0.16 mol D.0.14 mol
查看答案和解析>>
科目: 来源: 题型:
图中M%表示某反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反
应时间。图甲为压强与反应速率的关系曲线;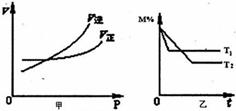
图乙为在不同温度时M%与时间的关系曲线。
可逆反应xA(气)+yB(气)![]() pC(气)+qD(气)符合如
pC(气)+qD(气)符合如
图两个图像,则
A.x+y<p+q, ΔH<0 B.x+y<p+q, ΔH>0
C.x+y>p+q, ΔH<0 D.x+y>p+q, ΔH>0
查看答案和解析>>
科目: 来源: 题型:
室温下,一元酸HA溶液与一元碱BOH溶液等体积混合,下列有关判断正确的是
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
C.若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足:
![]()
查看答案和解析>>
科目: 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定放电
电压。高铁电池的总反应为
![]()
下列叙述错误的是
A.放电时负极反应为:![]() —
—![]()
B.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
C.充电时阳极反应为:![]() —
—![]()
D.充电时阴极附近溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
下列各项内容中,排列顺序正确的是
①固体的热稳定性:![]()
②相同物质的量浓度的下列溶液中![]() 的浓度:
的浓度:![]()
③微粒半径:![]()
④给出质子的能力:![]()
⑤氢化物的沸点:![]()
A.①③ B.②④ C.①② D.③⑤
查看答案和解析>>
科目: 来源: 题型:
![]() 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.2L 1mol·L![]() (NH4)2SO4溶液中含有4
(NH4)2SO4溶液中含有4![]() 个铵根离子
个铵根离子
B.100℃时,1L pH=6的纯水中,含![]() 个
个![]()
C.电解CuCl2溶液,阴极析出6.4gCu时,转移的电子数为0.1![]()
D.一定条件下用含1mol FeCl3的溶液制备Fe(OH)3胶体,产生![]() 个Fe(OH)3胶粒
个Fe(OH)3胶粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com