
科目: 来源: 题型:
神六宇航员所穿舱内航天服是我国科学家近年来研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,下列相关叙述错误的是( )
A.它属于化合物 B.它耐高温,抗氧化,有柔韧性
C.它没有固定熔点 D.它是一种新型无机非金属材料
查看答案和解析>>
科目: 来源: 题型:
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
![]() ①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
①2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
![]() ②2CO(g)+4 H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
②2CO(g)+4 H2(g) CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
 (3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
| 500 | 600 | 700 | 800 | |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
 ②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2 (g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= —534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
查看答案和解析>>
科目: 来源: 题型:
含镉汞废水是世界上危害较大的工业废水之一,像汞进入人体逐渐积累就会出现大脑损害为主要特征的病——水俣病,工业上常需对此类污水处理,其中汞废水处理有硼氢化钠(NaBH4)还原法,原理为:BH4-+Hg2++20H-=BO2-+3H2 +Hg ,下列说法不正确的是
A、反应过程中生成1molHg共转移电子为4mol
B、还原剂是Hg2+氧化剂为BH4-
C、硼氢化钠处理含汞废水时,废水应调为弱碱性
D、这种处理含汞废水的最大优点是可以直接回收金属汞
查看答案和解析>>
科目: 来源: 题型:
标况时,将2.24L CO2通入1.5mol/L,100mLNaOH溶液中,
充分反应后(忽略溶夜体积的变化)所得溶液中,下列说法正
确的是
A、C(Na+)+C(H+)=C(CO32-)+C(HCO3-)+C(OH-)
B、C(Na+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+)
C、C(OH-)- C(H+)=2C(H2CO3)+ C(HCO3-)
D、1.0mol/L=C(CO32-)+ C(HCO3-)+ C(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【有机化学基础】
请仔细阅读以下转化关系:

A是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;
B称作冰片,可用于医药和制香精,樟脑等;
C的核磁共振氢谱显示其分子中含有4种氢原子;
D中只含一个氧原子,能与Na反应并放出H2;
F为烃。
请回答:
(1)B的分子式为 。
(2)B不能发生的反应是(填序号)___ _。
a.氧化反应 b.聚合反应 c .消去反应 d.取代反应 e.与Br2加成
(3)化合物H是F的同系物,相对分子量为56,H所有可能的结构共有____种;
(4)写出A的结构简式: 。
(5)写出E+D的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【物质结构与性质】
(1)已知某短周期元素的电负性是同族元素中最大的,其第一电离能高于其在周期表中直接相邻的元素,其原子最外电子层电子分布在两种形状的原子轨道中。请画出该元素最外电子层的电子排布图:
(2)已知能够自由移动的(CH3)3NH+和AlCl4 -可形成离子液体,由这两种离子形成的晶体的熔点低于100℃,则由这两种离子形成的晶体属于 晶体。
(3)X+中所有电子正好全部充满K、L、M三个电子层,它与N3—形成的晶体结构,如右图所示。请回答:
①用元素符号表示X+:
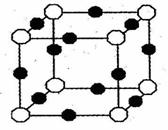 ②图中O表示的是:
②图中O表示的是:
③N3— 的配位数是
查看答案和解析>>
科目: 来源: 题型:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题:
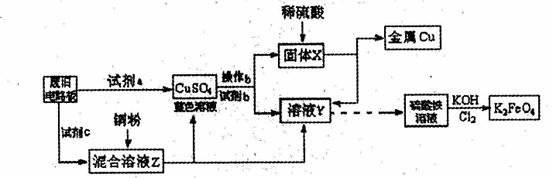
A.浓硫酸 B.硫酸铁溶液 C.氯水
D.H2 O2和稀硫酸 E. Fe
(2)加入过量试剂c,发生反应的离子方程式为__ ;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为__ _ _(填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)__ __配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到 (填“酸式”或“碱式”)滴定管中。
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)02时,转移电子的物质的量为 。K2Fe04与FeCl3相比,净水效果更好的是_ ,理由是 。
(4)高铁电池是一种新型可充电电池,总反应为:32n +2K2FeO4 +8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是: 。
查看答案和解析>>
科目: 来源: 题型:
I.飞机尾气中的NO会破坏臭氧层。利用催
化剂可使尾气中的NO和CO发生反应2NO +2CO
![]() 2CO2:+N2;△H<0。已知增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积.对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中
2CO2:+N2;△H<0。已知增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积.对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中
| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 1.20×10-3 | 124 | ||
| Ⅲ | 350 | 5.80×10-3 |
(1)请填全表中的各空格。
(2)请在右边给出的坐标图中,画出上表中的三
 个实验条件下混合气体中NO浓度随时间变
个实验条件下混合气体中NO浓度随时间变
化的趋势曲线图,并标明各条曲线的实验编号。
II.汽车内燃机工作时产生的高温会引起N2和O2的反应:
N2(g)+O2(g)![]() =2NO(g)是导致汽车尾气
=2NO(g)是导致汽车尾气
中含有NO的原因之一。
2000C时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则该反应的平衡常数K=___ _ 。该温度下,若开始时向上述容器中充入1 molN2和一定量的O2,平衡时O2与NO的物质的量恰好相等,则平 衡时N2的物质的量是 。
查看答案和解析>>
科目: 来源: 题型:
镁及其合金是用途广泛的金属材料,目前世界上60%的镁是从海水中提取 的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
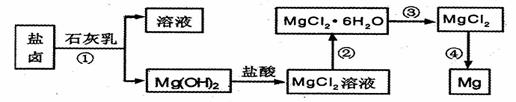
(1)从转化(①得到的Mg( OH)2沉淀中混有少量的Ca( OH)2,除去少量Ca( OH)2的方法是先将沉淀加入到盛有 的烧杯中,充分搅拌后经 __ __(填操作方法)可得纯净的Mg( OH)2,在此操作过程中,玻璃棒的作用是搅拌和 .
(2)写出转化④中发生反应的化学方程式___ _。
(3)已知转化③的反应原理与制取无水AlCl3相同下图是制取
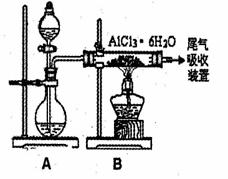 无水AlCl3实验装置图。装置A中的两液体分别是
无水AlCl3实验装置图。装置A中的两液体分别是
浓硫酸和浓盐酸。请回答:
①D为什么不直接加热来制取无水AlCl3,请用化学
方程式表示: ;
②分液漏斗中应盛装的试剂是__ __;
③由分液漏斗向烧瓶中加试剂时应注意的事项
是 。
查看答案和解析>>
科目: 来源: 题型:
在化学学习中使用数轴的表示方法可收到直观形象的效果,,下列表述中错误的是( )
A.分散质微粒的大小与分散系种类的关系:
![]()
B.常温下,溶液的pH与其酸碱性的关系:

C.硫的化合物中化合价与硫元素氧化性、还原性的关系:

D.Fe在Cl2中燃烧的产物与![]() 的关系:
的关系:
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com