
科目: 来源: 题型:
【物质结构与性质】
(1)已知某短周期元素的电负性是同族元素中最大的,其第一电离能高于其在周期表中直接相邻的元素,其原子最外电子层电子分布在两种形状的原子轨道中。请画出该元素最外电子层的电子排布图:
(2)已知能够自由移动的(CH3)3NH+和AlCl4 -可形成离子液体,由这两种离子形成的晶体的熔点低于100℃,则由这两种离子形成的晶体属于 晶体。
(3)X+中所有电子正好全部充满K、L、M三个电子层,它与N3—形成的晶体结构,如右图所示。请回答:
①用元素符号表示X+:
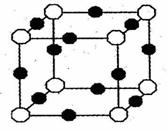 ②图中O表示的是:
②图中O表示的是:
③N3— 的配位数是
查看答案和解析>>
科目: 来源: 题型:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题:
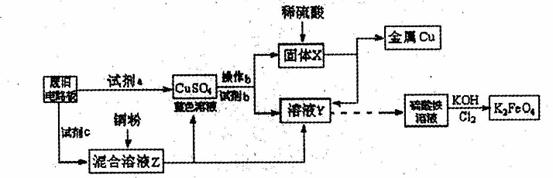
A.浓硫酸 B.硫酸铁溶液 C.氯水
D.H2 O2和稀硫酸 E. Fe
(2)加入过量试剂c,发生反应的离子方程式为__ ;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为__ _ _(填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)__ __配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到 (填“酸式”或“碱式”)滴定管中。
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)02时,转移电子的物质的量为 。K2Fe04与FeCl3相比,净水效果更好的是_ ,理由是 。
(4)高铁电池是一种新型可充电电池,总反应为:32n +2K2FeO4 +8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是: 。
查看答案和解析>>
科目: 来源: 题型:
I.飞机尾气中的NO会破坏臭氧层。利用催
化剂可使尾气中的NO和CO发生反应2NO +2CO![]() 2CO2:+N2;△H<0。已知增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积.对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中
2CO2:+N2;△H<0。已知增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积.对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中
实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 1.20×10-3 | 124 | ||
Ⅲ | 350 | 5.80×10-3 |
(1)请填全表中的各空格。
(2)请在右边给出的坐标图中,画出上表中的三
 个实验条件下混合气体中NO浓度随时间变
个实验条件下混合气体中NO浓度随时间变
化的趋势曲线图,并标明各条曲线的实验编号。
II.汽车内燃机工作时产生的高温会引起N2和O2的反应:
N2(g)+O2(g)![]() =2NO(g)是导致汽车尾气中含有NO的原因之一。
=2NO(g)是导致汽车尾气中含有NO的原因之一。
2000C时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则该反应的平衡常数K=___ _ 。该温度下,若开始时向上述容器中充入1 molN2和一定量的O2,平衡时O2与NO的物质的量恰好相等,则平 衡时N2的物质的量是 。
查看答案和解析>>
科目: 来源: 题型:
镁及其合金是用途广泛的金属材料,目前世界上60%的镁是从海水中提取 的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
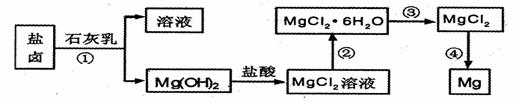
(1)从转化(①得到的Mg( OH)2沉淀中混有少量的Ca( OH)2,除去少量Ca( OH)2的方法是先将沉淀加入到盛有 的烧杯中,充分搅拌后经 __ __(填操作方法)可得纯净的Mg( OH)2,在此操作过程中,玻璃棒的作用是搅拌和 .
(2)写出转化④中发生反应的化学方程式___ _。
(3)已知转化③的反应原理与制取无水AlCl3相同下图是制取
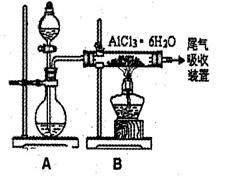 无水AlCl3实验装置图。装置A中的两液体分别是
无水AlCl3实验装置图。装置A中的两液体分别是
浓硫酸和浓盐酸。请回答:
①D为什么不直接加热来制取无水AlCl3,请用化学
方程式表示: ;
②分液漏斗中应盛装的试剂是__ __;
③由分液漏斗向烧瓶中加试剂时应注意的事项
是 。
查看答案和解析>>
科目: 来源: 题型:
在化学学习中使用数轴的表示方法可收到直观形象的效果,,下列表述中错误的是( )
A.分散质微粒的大小与分散系种类的关系:
![]()
B.常温下,溶液的pH与其酸碱性的关系:
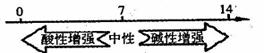
C.硫的化合物中化合价与硫元素氧化性、还原性的关系:
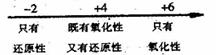
D.Fe在Cl2中燃烧的产物与![]() 的关系:
的关系:
![]()
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是 ( )
A.0.1 mol.L-lNH4Cl溶液:c(NH4+) =c(Cl一)
B.pH =4的盐酸与pH =10的氨水等体积混合后pH >7
C.0.1 mol.L一1与0.2mol.L一1氨水中c(OH一 )之比为1:2
D.中和pH与体积都相同的氨水和Ba( OH)2溶液,消耗HC1的物质的量之比是1:2
查看答案和解析>>
科目: 来源: 题型:
将标准状况下的aLHCI(气)溶于1000 g水中得到的盐酸密度为bg·' cm3,则该盐酸 的物质的量的浓度( mol/L)是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
A.Na2 O2、Na2O均能吸收CO2并放出氧气
B.Mg、Al、Fe均能在冷的浓硝酸中钝化
C.SO2:和C12:都有漂白性,其反应原埋相同
D.SiO2既能与NaOH反应,又能与Na2 CO3反应,并且都生成Na2SiO3
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式正确的是 ( )
A.用醋酸除水垢:CaCO3+2H+= Ca2++ H2O+CO2 ↑
B.用小苏打治疗胃酸过多:HCO3—+H+= CO2 ↑+H2O
C.向溴化亚铁溶液中通入足量氯气:2Br—+ Cl2=Br2 +2Cl—
D.向澄清石灰水中通人过量二氧化碳:Ca2+ +2OH— +CO2:=CaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
NA代表阿伏加德罗常数,下列叙述错误的是 ( )
A.标准状况下,22.4LO2:和N2的混合气体中分子总数为NA
B.常温常压下,1molI2固体中,含有I原子数为2NA
C.Na2O2:与H2O反应生成16gO2:时,转移电子数为NA^
D.标准状况下,分子数均为NA的H2和H2O,它们所占的体积相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com