
科目: 来源: 题型:
下列说法中正确的是
A.有单质参加或有单质生成的化学反应不一定是氧化还原反应
B.有化学键断裂或有化学键形成的变化一定是化学变化
C.若A元素的金属性强于B元素的金属性,则A一定可置换B盐溶液中的B
D.弱酸不可能制得强酸,弱酸盐也不可能制得强酸盐
查看答案和解析>>
科目: 来源: 题型:
下列各组离子,一定能大量共存的是
A.常温下,c(H+)/c(OH-)=1×10-12的溶液:I-、Cl-、HCO3-、Na+
B.含有大量Fe3+的溶液:Na+、HCO3-、NO3-、CO32-
C.加入铝粉能产生氢气的溶液:Cl-、Na+、SO42-、NO3-
D.由水电离出的c(H+)=1×10-12 mol?L-1溶液中:K+、Cl- 、NO3- 、Na+
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,22.4 L三氯甲烷中共价键数目为4NA
B.1mol Na2O2与足量的CO2和H2O(g)的混合物反应,转移的电子数为NA
C.足量MnO2与含4 mol HCl的浓盐酸反应生成的Cl2分子数为NA
D.1mol Cl2溶于水中转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
生物柴油是以果实、种子、植物油或动物脂肪、废弃的食物油等为原料,经酯交换反应制得的脂肪酸单烷基酯。下列关于生物柴油的叙述不合理的是
A.生物柴油含硫量低,可减少二氧化硫的排放
B.生物柴油在一定条件下可发生水解
C.生物柴油推广不符合“绿色化学”
D.生物柴油是一种可再生能源
查看答案和解析>>
科目: 来源: 题型:
将2.44g BaCl2·xH2O配成100mL溶液。25mL此溶液中的Cl-恰好能与0.1mol·L-1的AgNO3溶液50mL完全反应。计算:
(1)此溶液中溶质的物质的量浓度。(3分)
(2)BaCl2·xH2O中的x的值。(4分)
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线。
Ⅱ.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:X ,Y ,M ,N 。
(2)请写出 Y单质与NaOH溶液反应的离子方程式: 。
(3)Y与Z相比,非金属性较强的元素是 ,可以证明该结论的实验是(用离子方程式表示) 。
(4)用电子式表示Y和M形成化合物的形成过程: 。
查看答案和解析>>
科目: 来源: 题型:
下图是实验室制SO2并验证SO2某些性质的装置图:
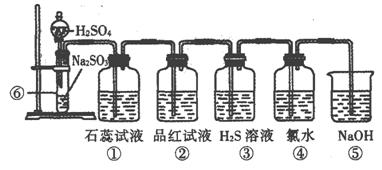
试回答:![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m
(1)⑥中发生的化学反应方程式为:____________________________________。
(2)①中实验现象为________________,证明SO2与水反应后溶液呈_____________。
(3)②中品红溶液现象为______________________,证明SO2有____________性。
(4)③中现象是_____________________,证明SO2有_________性。
反应的化学方程式为 。
(5)④中现象是_____________________,证明SO2有_________性。
反应的离子方程式为 。
(6)⑤的作用是_____________________,反应的离子方程式为:____________________。
查看答案和解析>>
科目: 来源: 题型:
现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1。试回答:
(1)B是 、E是________ 。(写元素名称):
(2)A的原子结构示意图 ,B的离子结构示意图
D的单质分子的电子式 , C元素最高价氧化物的水化物的电子式 。
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
, 。
(4)比较B、C、E三种元素形成的简单离子其离子半径的大小和氧化性的强弱:(B、C、E离子用实际离子符号表示)
离子半径: ;氧化性: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com