
科目: 来源: 题型:
我国在青藏高原发现了名为“可燃冰”的环保型新能源。
(1)“可燃冰”属于化石燃料,主要成分是CH4。另外还有两种化石燃料,它们的名称分别是 和 。
(2)CH4可与Cl2反应,反应历程如下
①Cl—Cl→2Cl· ΔH= 243 kJ·mol-1
②Cl·+CH3—H→·CH3+H—Cl ΔH= 4 kJ·mol-1
③·CH3+Cl—Cl→CH3——Cl+Cl· ΔH= -106 kJ·mol-1
则CH4与Cl2反应生成CH3—Cl(g)的热化学方程式为 。
(3)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示:
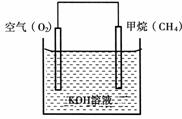
则通入CH4的一极为原电池的 (填“正极”或“负极”),正极的电极反应式为 。
(4)CH4与H2O在隔绝空气、高温和催化剂条件下反应:
CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=m kJ·mol-1
则反应的平衡常数表达式K= , K的大小与温度(T)的关系如右图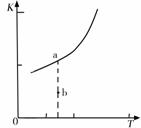 中曲线所示,则m 0(填“>”“=”或“<”);改变某一条件,使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,则CH4的转化率 (填“增大”、“减小”、“不变”或“不确定”),反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
中曲线所示,则m 0(填“>”“=”或“<”);改变某一条件,使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,则CH4的转化率 (填“增大”、“减小”、“不变”或“不确定”),反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
已知,2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
MnO2+4HClMnCl2+Cl2↑+2H2O
其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(﹥6 mol·L-1)反应,MnO2需和浓盐酸(﹥8 mol·L-1)反应。
以下结论中,不正确的是
A. 上述反应既属于氧化还原反应,又属于离子反应
B. 生成1 mol Cl2转移电子数均为2 NA(NA为阿伏加德罗常数)
C. 氧化性:KMnO4﹥K2Cr2O7﹥Cl2﹥MnO2
D. 盐酸的浓度越大,Cl-的还原性越强
查看答案和解析>>
科目: 来源: 题型:
CaCO3溶于盐酸生成CO2:CaCO3+2HCl=CaCl2+ CO2↑+H2O。则下列说法中,正确的是
A. 该反应的离子方程式为CO32-+2H+=CO2↑+H2O
B. 与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大
C. CaCO3溶于盐酸是因为H+ 破坏了CaCO3的沉淀溶解平衡,使其Ksp增大
D. CaCO3与适量的盐酸恰好完全反应所得溶液中c (H+)=c (OH-)+2c (CO32-)+c (HCO3-)
查看答案和解析>>
科目: 来源: 题型:
下列关于有机物的说法中,不正确的是
A. 糖类、油脂和蛋白质都能发生水解反应
B. 乙烯、氯乙烯均可用于合成塑料
C. 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应
D. 分子式为C5H12的有机物只有三种,它们属于同分异构体
查看答案和解析>>
科目: 来源: 题型:
下列有关溶液的说法中,正确的是
A. 含H+的溶液显酸性,含OH-的溶液显碱性
B. 用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体
C. 某饱和溶液变成不饱和溶液,溶质的质量分数一定减小
D. 标准状况下,2.24 L NH3溶于水制得1L氨水,则c (NH3·H2O)=0.1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
下列有关结构和性质的说法中,正确的是
A. 酸性:HCl>H2S,所以,非金属性:Cl>S
B. 元素原子的最外层电子数越多,越容易得电子,非金属性越强
C. 同周期主族元素的原子形成的简单离子电子层结构相同
D. 同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1
查看答案和解析>>
科目: 来源: 题型:
S8分子形成的单斜硫和斜方硫是同素异形体,转化关系如下
![]()
![]()
若NA为阿伏加德罗常数,则下列说法中,不正确的是
A. 单斜硫比斜方硫具有的能量略高
B. 单斜硫和斜方硫之间的转化属于物理变化
C. 单斜硫和斜方硫在充足的氧气中燃烧均生成SO2
D. 64g 单斜硫和斜方硫的混合物含硫原子数目为2NA
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,正确的是
A. 太阳能、核能和天然气都属于新型能源
B. 哥本哈根气候大会讨论的减排目标主要是控制二氧化硫排放
C. 84消毒液具有强氧化性,可杀死流感病毒
D. 济南奥体中心比赛场馆“东荷”、“西柳”所用的材料都是新型无机非金属材料
查看答案和解析>>
科目: 来源: 题型:
利用碳棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。试计算:
(1)有多少个电子通过了导线。
(2)原稀硫酸溶液的物质的量浓度。
查看答案和解析>>
科目: 来源: 题型:
t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() xc(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请计算:
xc(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请计算:
(1)从反应开始到平衡状态,生成C的平均反应速率;
(2)x的值;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com