
科目: 来源: 题型:
以下实验能获得成功的是( )
A.用酸性KMnO4溶液鉴别乙烯和乙炔 B.将乙烷与溴水混合光照制溴乙烷
C.苯和硝基苯的混合物采用分液的方法分离 D.可用CCl4作萃取剂萃取碘水中的碘
查看答案和解析>>
科目: 来源: 题型:阅读理解
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两
个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有lO个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物
质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极
性分子的有 (写化学式)。
(2)下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子由各原子最外层均为8![]() 。的稳定结构
。的稳定结构
d.含1 mol B的液体中有3 mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
 是 。
是 。
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结
构,右图立方体中心的“●”表示该晶体中的一个原子,请在该
立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中
不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键
f.配位键 g.![]() 键 h.
键 h.![]() 键
键
B.对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:


实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100mL,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
查看答案和解析>>
科目: 来源: 题型:
硫酸在生产中有广泛的应用,某厂以硫铁矿为主要原料生产硫酸。
已知:①550℃时,![]() △H=-196.6KJ.mol-1
△H=-196.6KJ.mol-1
②一定温度下,硫铁矿在空气中煅烧可能发生下列反应(设空气中N2与O2的体积
比为4:1):![]() ,
,![]()
(1) 550℃时,6.4 g SO2(g)与足量O2(g)充分反应生成SO3(g),放出热量
9.83 kJ (填“大于”、“等于”或“小于”)。
(2)欲使反应①的平衡向正反应方向移动,下列措施可行的是 。(填字母)
a.向平衡混合物中充入Ar b.向平衡混合物中充入O2
c.改变反应的催化剂 d.降低反应的温度
(3)为使FeS2完全生成Fe2O3,生产时要使用过量的空气,则当空气过量50%时,所得炉气中SO2的体积分数是多少?
(4)720 g纯净的FeS2在空气中完全煅烧,所得固体中Fe和O的物质的量之比n(Fe):n(O)=6: ![]() ,
,
此时消耗空气为![]() mol。
mol。
①试写出a与b的关系式: 。
②请在右图中画出![]() 与
与![]() 的关系曲线。
的关系曲线。
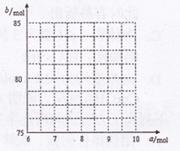
查看答案和解析>>
科目: 来源: 题型:
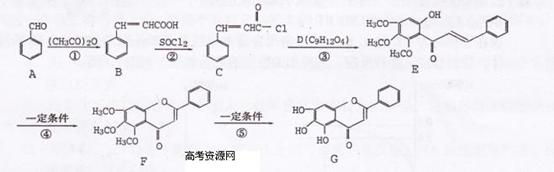
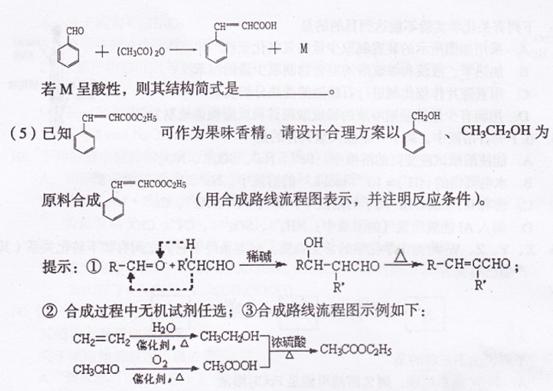
化合物G是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。G的
合成路线如下:
请回答下列问题:
(1)G中含有的含氧官能团的名称有 。
(2)反应③为取代反应,D的结构简式是 ,D分子中含有 种不同化
学环境的氢原子。
(3)同时符合下列a、b、c三个条件的B的同分异构体共有 种。
a.能发生银镜反应;b.属于苯的衍生物,苯环上共有3个链状取代基;c.与
FeCl3溶液发生显色反应
(4)反应⑤的反应类型是 。在反应①中,反应物的物质的量之比为1:l,
反应的化学方程式如下:
查看答案和解析>>
科目: 来源: 题型:
近年,我国在航天事业上取得了令世界瞩目的成就,神舟飞船多次被长征系
列火箭送入太空。
(1)长征二号捆绑式火箭推进剂以联氨(N2H4)作为燃料,N2O4作为推进剂。
①N2O4的主要作用是助燃,但其在工作时会产生红棕色气体NO2,对环境会造
成污染,为避免污染可使用下列 (填字母)代替之。
A.液态氨 B.H2O2 C.KMnO4 D.液态氧
②在碱性条件下,用尿素[CO(NH2)2]和次氯酸钠反应可以制取联氨(产物中
同时有两种正盐),则该反应的离子方程式是 。
(2)飞船座舱内空气的更新过程如下图所示:
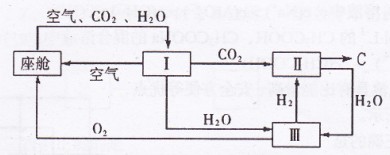
①座舱内空气更新过程可以循环利用的物质为H2、O2和 ;装置Ⅱ中
发生反应的化学方程式为 。
②从装置I、Ⅱ、Ⅲ可看出O2的来源,若宇航员每天消耗35mol O2,每天呼出
的气体中含18 molH2O,则呼出的气体中含CO2 mol.
查看答案和解析>>
科目: 来源: 题型:
大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以N2+O2![]() 2NO为例)、人工固氮(以为N2+3H2
2NO为例)、人工固氮(以为N2+3H2![]() 2NH3 为例)反应的平衡常数
2NH3 为例)反应的平衡常数![]() 的值如下表。
的值如下表。
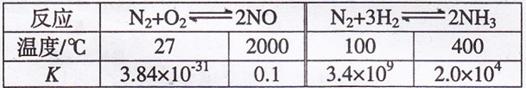
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ.mol-1
2NH3(g) △H=-92.4KJ.mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6KJ.mol-1
据报道,在常温、常压、光照、催化剂的条件下,![]() 可以与水反应,则反应
可以与水反应,则反应
N2(g) + 3H2O(l)= 2NH3(g) +3/2O2(g)的 △H= KJ.mol-1
(3)某研究小组在673 K、30 MPa下,在体积为VL的密闭容器中进行反应:,N2(g)+3H2(g)![]() 2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
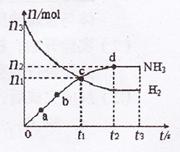
①下列叙述正确的是 填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则n(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)v(H2)= .
③若开始时n(N2)= n(H2),则反应的平衡常数K= (用代数式表示).
查看答案和解析>>
科目: 来源: 题型:
重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为
Cr203,还含有FeO、A1203、Si02等杂质)为原料制取重铬酸钠的流程如下:
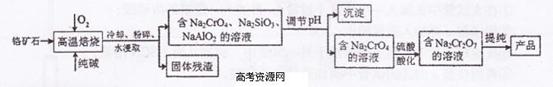
 请回答下列问题:
请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为 。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAl02
的溶液)pH的目的是 。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了
Na2Cr04转化为Na2Cr207的生产,其原理如右图所示。
①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被
氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入cl mol/L。的
Na2Cr207溶液V1mL,使水中的还原性物质完全被氧化(还原产物为Cr3+);再用
![]()
![]() 的FeS04溶液滴定剩余的Cr2O72-,结果消耗FeS04溶液V2mL。则该水
的FeS04溶液滴定剩余的Cr2O72-,结果消耗FeS04溶液V2mL。则该水
样的COD为 mg/L。
查看答案和解析>>
科目: 来源: 题型:
某兴趣小组根据金属镁与C02的反应,推测金属钠也能与C02发生反应,因此
他们用下图所示的装置进行“钠与C02反应”的探究(尾气处理装置略去).又知实
验过程中的C02气体为足量;设能发生的反应都进行完全;一氧化碳气体可用氯化钯
(PdCl2)溶液来检验(通过溶液颜色的变化来判断)。
(1)为了使制取气体的装置能“随开随用,随关随停”,则在图中A处应选用的装置是 (填“I”、“Ⅱ”或“Ⅲ”).若要用干燥、纯净的C02气体与金属钠反应,则装置B中应盛放的试剂是 溶液。
(2)实验开始,检查装置的气密性完好并装入有关药品后,在点燃酒精喷灯前,还必须进行的实验操作是 。
(3)反应完成后,装置D玻璃管中残留的固体物质可能是 。(填字母)
![]() .Na202 b.Na2C03 c.NaHCO3 d.Na2C03和C
.Na202 b.Na2C03 c.NaHCO3 d.Na2C03和C
(4)若D玻璃管中残留的固体是纯净物,则钠与C02反应的化学方程式是 。
(5)请设计合理的实验来检验某固体物质是Na2C03.答: 。
查看答案和解析>>
科目: 来源: 题型:
某化学学习小组用如图所示装置研究不同条件下铁与硝酸反应的情况。其实验
步骤如下:

①在大试管中先加入一小块铁(过量),再加入一定量的浓硝酸;
②用仪器a再加入适量的水;
③反应结束后取少量上层溶液于另一试管中,滴加几滴KSCN溶液;
④再用仪器a向③的试管中滴加适量的稀盐酸。
请回答下列问题:
(1)仪器a的名称是 。
(2)步骤①无明显现象,原因是 。
(3)步骤④的主要现象是 ,有关反应的离子方程式是 。
(4)学习小组在进行实验后发现该实验装置存在着一种明显的缺陷,请给出一种简单
的消除此缺陷的措施: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com