
科目: 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
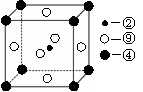 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”)。
查看答案和解析>>
科目: 来源: 题型:
工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀。废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:
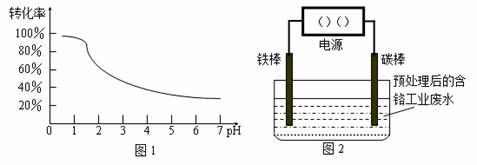
请根据以上知识回答下列问题:
⑴ 含铬废水预处理的方法是 。
⑵ 在图2中连接铁棒的一极是电源的 极。
⑶ 实验中除能观察到废水颜色发生变化外,还能观察到的现象是 。
表一:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.5 | 4.3 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 5.6 | 5.2 |
⑷ 当废水颜色不再发生明显变化时,切断电源,取出电极,再调节电解液的pH至8左右。调节pH的目的是 。
⑸ 含铬废水国家排放标准为![]() 含量≤0.1000mg/L。取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL。已知酸性条件下,I-被Cr2O72-氧化的产物为I2。用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准 。
含量≤0.1000mg/L。取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL。已知酸性条件下,I-被Cr2O72-氧化的产物为I2。用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准 。
查看答案和解析>>
科目: 来源: 题型:
某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍。A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是 。
(2)已知:
ⅰ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. ![]()
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。

请回答:
① 步骤Ⅰ的目的是 ;
② 若G为碳酸,则E的结构简式是 ;E的核磁共振氢谱中有 个吸收峰(填数字);③ F→H的反应类型是 ;
④ F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式 ;
⑤ A的结构简式是 ;上述转化中B→D的化学方程式是 。
(3)已知A的某种同分异构体N具有如下性质:
① N与FeCl3反应,溶液呈紫色;
② N在一定条件下可发生银镜反应,N与H2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应;
③ 在通常情况下,1mol N能与含1mol Br2的浓溴水发生取代反应;
④ N分子中苯环上的取代基上无支链。
请写出:N可能的结构简式 (写一种即可)。KmnO4/H+
(4)请设计合理方案,完成从 到的合成
到的合成 路线(用合成路线流程图表示,并注明反应条件)。
路线(用合成路线流程图表示,并注明反应条件)。
提示:①;合成过程中无机试剂任选;②合成路线流程图示例如下:
CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() CH2-CH2
CH2-CH2![]()
查看答案和解析>>
科目: 来源: 题型:阅读理解
工业合成氨与制备硝酸一般可连续生产,流程如下:
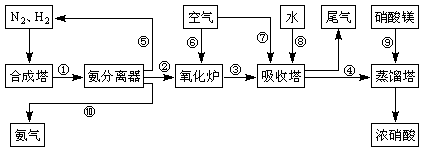
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)![]() CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=________。

(2)合成塔中发生反应N2(g)+3H2(g)![]() 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
T1____573K(填“>”、“<”或“=”)。
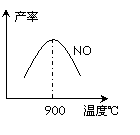
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因 。
(4)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)= mol/L。
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 。与方法一相比,方法二的优点为 。
查看答案和解析>>
科目: 来源: 题型:
2007年度http://today.ks5u.com诺贝尔化学奖获得者格哈德·埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ·mol-1。(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:
(1)合成氨反应的机理为
① ;
![]()
![]()
![]() ②N2 N2吸 2N 2N吸
②N2 N2吸 2N 2N吸
③ ;
![]() ④NH吸+H吸 NH2吸;
④NH吸+H吸 NH2吸;
![]()
![]() ⑤NH2吸+H吸 NH3吸 NH3。
⑤NH2吸+H吸 NH3吸 NH3。
(2)T=673K时,合成氨反应的热化学方程为 。
(3)液氨与水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为:
![]() 2NH3 NH+4+NH-2(某温度http://today.ks5u.com下其离子积常数为10-30)。液氨中的pNH4与水中的pH类似,则该温度http://today.ks5u.com下液氨的pNH4= 。
2NH3 NH+4+NH-2(某温度http://today.ks5u.com下其离子积常数为10-30)。液氨中的pNH4与水中的pH类似,则该温度http://today.ks5u.com下液氨的pNH4= 。
(4)盐酸肼(N2H4Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式 。
(5)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,N2H4在氧气中完全燃烧生成氮气,肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:
负极的电极反应式是 。
查看答案和解析>>
科目: 来源: 题型:
锂在原子能工业中具有十分独特的地位,被誉为“高能金属”,它推动着能源工业,尤其是电池技术的发展。盐湖卤水中锂的含量较高,资源丰富,提炼锂的价格低廉,成为国内外开发生产锂的主攻方向。把盐湖卤水自然日晒和冷冻,从卤水中析出食盐、泻利盐、钾盐镁矾和光卤石等一系列盐类,得到富含MgC12的浓缩母液,其中LiC1的浓度达10%以上。把浓缩母液经高温炉分解除去MgC12等一系列过程,最终得到金属锂。其主要生产工艺流程如下:
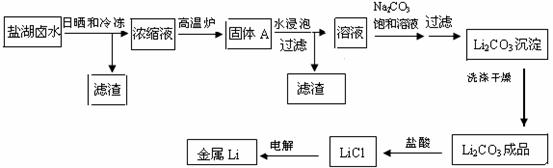 已知:Li2CO3在不同温度的溶解度如下表:
已知:Li2CO3在不同温度的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)写出浓缩母液在高温炉中分解的化学方程式
(2)写出盐酸与Li2CO3反应的离子方程式
(3)洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)熔融LiCl电解的环境是
a.氢气中b.氮气中c.空气中d.真空中e.He气
查看答案和解析>>
科目: 来源: 题型:阅读理解
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:居室中甲醛含量不得超过0.08 mg/m![]() 。可利用酸性高锰酸钾溶液测定甲醛含量。
。可利用酸性高锰酸钾溶液测定甲醛含量。
测定原理:KMnO4 (H![]() )溶液为强氧化剂,可氧化甲醛和草酸。
)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为: 4MnO4—+5HCHO+12H+ ![]() 4Mn2++5CO2↑+11H2O
4Mn2++5CO2↑+11H2O
2MnO4—+5H2C2O4+6H+ ![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
 |
测定装置:部分装置如右图所示(a、b为止水夹)。
测定步骤:
①收集待检新装修的房屋居室空气5 L。
②准确量取5.00 mL 1.00×10![]() mol/L的高锰酸
mol/L的高锰酸
钾溶液于250 mL锥形瓶中,滴入3滴6 mol/L
的H![]() SO
SO![]() 溶液,加水45 mL稀释,备用。
溶液,加水45 mL稀释,备用。
③将1.00×10![]() mol/L的草酸标准溶液置于酸式滴定管中备用。
mol/L的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
回答以下问题:
(1)使用_________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?使结果偏高还是偏低? 。
(3)本实验是否需要外加指示剂?若需要请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
。
(4)计算该居室内空气中甲醛的浓度_________mg/m![]() ,该居室的甲醛________(填“是”或“否”)超标。
,该居室的甲醛________(填“是”或“否”)超标。
查看答案和解析>>
科目: 来源: 题型:
教材中经常利用如图装置进行有关物质的制备和性质检验。
|
(1)请按要求填充下表空格
| 实验名称 | 选用的仪器(填字母) | C或D中所盛试剂(填名称) | C或D中的现象 |
| 区别固体Na2CO3和NaHCO3 | BD | 澄清石灰水 | |
| 铜和浓硫酸反应 | AC | 溶液红色褪去 | |
| 制备乙酸乙酯 | 饱和碳酸钠溶液 | 上层有透明油状液体产生并有香味 |
(2)针对上述实验下列说法正确的是(填字母代号) 。
A.Cu和浓硫酸反应时,可在装置C的试管口塞沾有碱液的棉花
B.加热已吸收Cu和浓硫酸反应生成物的溶液不能出现红色
C.制备乙酸乙酯时,装置C的导管末端在液面以下
D.B装置可用于制备氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com