
科目: 来源: 题型:
下列说法正确的是( )
A.在101 k Pa时,1 mol C与适量![]() 反应生成1mol CO时,放出110.5 kJ热
反应生成1mol CO时,放出110.5 kJ热
量,则C的燃烧热为110.5 kJ/mol
B.在10l k Pa时,l mol![]() 完全燃烧生成液态水,放出285.8 kJ热量,
完全燃烧生成液态水,放出285.8 kJ热量,![]() 燃烧热
燃烧热
为 —285.8KJ/mol
C.鉴定HCL和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起
始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:![]() ,若将含
,若将含
0.5mol![]() 的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ
的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ
查看答案和解析>>
科目: 来源: 题型:
某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。
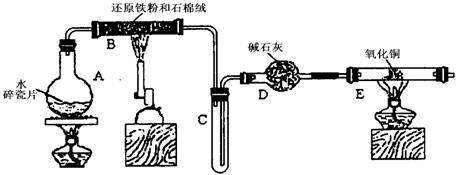
(1) 给硬质玻璃管B加热的仪器名称是_________
(2)B中发生反应的化学方程式是___________________________________________。
(3)为了安全,加热E以前必须进行的操作是_________________________________。
(4)已知有反应:Cu2O+2H+![]() Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(5)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成或铜的摩尔质量。若反应前盛有药品的E、F的质量分别是bg、cg,反应后分别是dg、eg。
①水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= _______︰_______;若反应后E中除Cu外还含有另种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
②若空的E管的质量为ag,加热后CuO完全还原为Cu,则铜的摩尔质量可表示为______________________________。
(6)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:____________(若为混合物,需计算出各自的质量)
查看答案和解析>>
科目: 来源: 题型:
I.某一芳香族化合物分子式为C9H8O4 ,其苯环上只能生成两种一溴取代物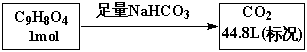
它的结构简式可能为_______________________。
II.A、B、C、D、E、F都是链状有机物,它们的转化关系如图所示。A中只含有一种官能团,D中含有两种官能团,D分子中不含甲基,且与碳原子相连的氢原子取代所得的一氯代物只有1种。请回答下列问题: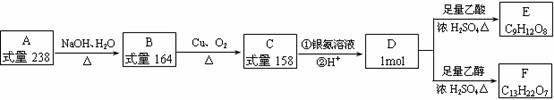 (1)D中含有官能团 ,D的分子式 。
(1)D中含有官能团 ,D的分子式 。
(2)写出D的结构简式 ,A的结构简式 。
(3)写出B生成C的化学方程式 。
(4)写出C与银氨溶液反应的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):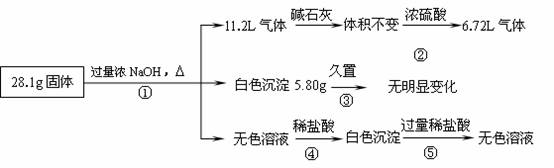 回答下列问题:
回答下列问题:
⑴混合物中是否存在FeCl2 (填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
⑶写出反应④的离子反应式: __ 。
⑷请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
。
⑸把AlCl3溶液中加热浓缩蒸干,不能得到AlCl3·6H2O晶体,请你设计一个可行的简易实验方案,怎样从溶液中得到较纯的AlCl3·6H2O晶体。
。
查看答案和解析>>
科目: 来源: 题型:
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
Ⅰ.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式______。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示) 。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。写出上述化学反应方程式:_____________________________________________________。
Ⅱ.在恒温条件下,起始时容积均为5 L的甲、乙两密闭容器中(甲为恒容容器、 乙为恒压容器),均进行反应:N2+3H2![]() 2NH3,有关数据及平衡状态特点见下表。
2NH3,有关数据及平衡状态特点见下表。
| 容器 | 起始投入 | 达平衡时 | ||
| 甲 | 2 mol N2 | 3 mol H2 | 1.5 mol NH3 | 同种物质的体积分数相同 |
| 乙 | a mol N2 | b mol H2 | 1.2 mo l NH3 | |
(4)下列能表明容器乙一定达平衡状态的是____________(填字母)
A.容器内的混合气体的平均相对分子质量不再变化
B.容器内的氮元素的质量不再变化
C.氢气的生成速率与氨气的消耗速率之比为2∶3
D.形成1 mol N≡N键的同时形成6 mol N—H键
(5)甲容器中氮气的转化率为 。
(6)起始时,容器乙是容器甲压强的_________倍。
查看答案和解析>>
科目: 来源: 题型:
已知NO2与N2O4相互转化:2NO2(g)![]() N2O4(g);△H=-24.4kJ/mol在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如右图。下列推理分析合理的是
N2O4(g);△H=-24.4kJ/mol在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如右图。下列推理分析合理的是
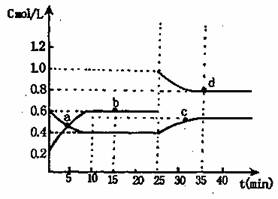
A.前10min内,用v(NO2)表示的该反应速率为0.02mol/(L·min)
B.反应进行到10min时,体系吸收的热量为9.76kJ
C.a,b,c,d四点中v正与v逆均相等
D.25min时,导致平衡移动的原因是升温
查看答案和解析>>
科目: 来源: 题型:
用铅蓄电池作电源电解某溶液100mL。已知该溶液中含SO2、KI,其物质的量的浓度均为
0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是 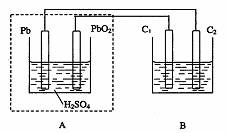
A.铅蓄电池工作一段时间后A溶液的pH变小
B.当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol
C.当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过
D.铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4 PbSO4+2H2O+SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com