
科目: 来源: 题型:
在25℃时,有pH=a的盐酸和pH=b的NaOH溶液,取VaL盐酸与NaOH溶液中和,需VbL NaOH溶液,问:
(1)若a+b =14、则Va/Vb= (填数字)。
(2)若a+b =13、则Va/Vb= (填数字)。
(3)若a+b >14、则Va/Vb= (填数字),且Va Vb(填>、<或=)。
(4)若a+b =15、则Va/Vb= (填数字)。
查看答案和解析>>
科目: 来源: 题型:
76.8mgCu与足量浓硝酸反应,铜作用完全后,如果NO3-减少2×10-3mol,则溶液中H+同时下降 ( )
A 2.2×10-3mol B 3.2 ×10-3mol C 4.4×10-3mol D 4.8×10-3mol
查看答案和解析>>
科目: 来源: 题型:
某学生要用50 mL NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石⑥饱和NaHCO3溶液
实验室有下列仪器:量筒,烧杯,橡皮管,玻璃导管,分液漏斗,烧杯,洗气瓶,酒精灯。
已知下表中各物质在常温时的溶解度(g/100 g H2O)
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
本实验除了下面图给的仪器外,还应有: (仪器安装补完整)。
实验为保证制得Na2CO3的纯度,应选用的药品,除①外,还应需要: 。
简要叙述实验步骤,直到制得纯碳酸钠溶液 。
根据给出的溶解度表,若保证在配制过程中不会有晶体析出,所用氢氧化钠溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
查看答案和解析>>
科目: 来源: 题型:
窗体底端
窗体顶端
将碳酸氢铵在试管中加热,使放出的气体依次通过盛有足量过氧化钠和水的容器,最后得到的气体是( )
A、氧气 B、二氧化碳 C、氨气 D、水
查看答案和解析>>
科目: 来源: 题型:
W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W ,X ,Y ,Z 。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是 ;根据电子云重叠方式的不同,分子里共价键的主要类型有 。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是 (写化学式),其原因是该化合物阴离子间可形成二聚离子或多聚链状离子。该化合物阴离子能够相互缔合的原因是:
。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
Ⅱ、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g)![]() 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g)![]() 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
查看答案和解析>>
科目: 来源: 题型:
工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
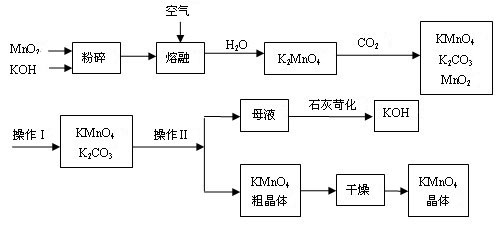
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是______(填代号)。
a.浓硝酸 b.硝酸银 c.氯水 d.烧碱
(3)上述流程中可以循环使用的物质有 . (写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号) 。
a.石灰石 b.稀HCl c.稀H2SO4 d.纯碱
(6)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤).趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目: 来源: 题型:
取少量MgO、A12O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应后过滤,得到沉淀X和滤液Y。下列叙述正确的是( )
A.上述四种氧化物对应的水化物中,Al(OH)3酸性最强
B.向沉淀X中逐滴加入硝酸,沉淀慢慢溶解
C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
D.溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
查看答案和解析>>
科目: 来源: 题型:
0.6 mol Cu2S和一定量HNO3溶液恰好完全反应,生成Cu(NO3)2、H2SO4、NO和H2O,则反应中未被还原的HNO3的物质的量是
A.0.6 mol B.2.4 mol C. 0.3 mol D.1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com