
科目: 来源: 题型:
合成氨中,1体积N2和3体积H2混合进入合成塔进行反应,从塔里排出的混合气体中若NH3占总体积的12%,则N2占总体积的( )
A.12% B.22% C.33.3% D.66.7%
查看答案和解析>>
科目: 来源: 题型:
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1∶7 B.1∶9 C.1∶5 D.2∶9
查看答案和解析>>
科目: 来源: 题型:
(本小题15分)为测定空气中CO2含量,做下述实验。
| 配0.1mol/L的标准盐酸和0.01mol/L的标准盐酸 | → | 用0.1mol/L的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60 mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol/L的盐酸滴定用去盐酸34.8mL |
(1)为配置标准溶液,请选取必需的一组仪器 。
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
A.①②⑤⑥ B.②④⑤⑥⑦ C.②①⑥⑦ D.②④⑤⑥
(2)滴定操作时,左手 ,眼睛注视 。
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤。需过滤的原因是 。
(4)由实验数据算出空气中CO2的体积分数为 。
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即更换溶液,进行第二次滴定,导致实验数据值(填偏高、偏低或无影响) 。
查看答案和解析>>
科目: 来源: 题型:
(1) 实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
![]() 四种盐在不同温度下的溶解度(g / 100 g水)表
四种盐在不同温度下的溶解度(g / 100 g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
请回答: ![]()
![]()
![]()
![]()
![]() ①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为 ;
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为 ;
![]() ②加料完毕,保温30分钟,目的________________________ ;
②加料完毕,保温30分钟,目的________________________ ;
![]() ③静置后只析出NaHCO3晶体的原因__________________________ ;
③静置后只析出NaHCO3晶体的原因__________________________ ;
![]() ④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
![]() (2)我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
(2)我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
![]()
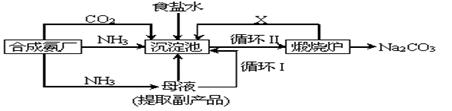
![]() ⑤沉淀池中反应的化学方程式: _______-_______ __ ;
⑤沉淀池中反应的化学方程式: _______-_______ __ ;
![]() ⑥检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
⑥检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
![]() ⑦循环(I)中应该加入或通入物质的化学式为 。
⑦循环(I)中应该加入或通入物质的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
可逆反应aA(g)+bB(s)![]() cC(g)+dD(g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC(g)+dD(g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )

A.温度降低,化学平衡向逆反应方向移动
B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d
D.无法根据图像确定改变温度后化学平衡移动方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com