
科目: 来源: 题型:
下列实验方法能达到要求的是( )
A.用100mL量筒量取3.75 mL的稀H2SO4
B.用托盘天平称量12.30 g的NaCl晶体
C.用广泛pH试纸测得某溶液的pH为3
D.用250 mL容量瓶配制150 mL一定浓度的稀HCl.
查看答案和解析>>
科目: 来源: 题型:
20 ℃时,有甲、乙、丙三瓶质量相等的饱和KNO3溶液,若将甲降至10 ℃,将乙恒温蒸发掉10 g水,从丙中取出一半溶液,此时甲、乙、丙溶液的物质的量浓度的大小关系为( )
A.乙>甲>丙 B.乙>丙>甲
C.丙>乙>甲 D.甲<乙=丙
查看答案和解析>>
科目: 来源: 题型:
20 ℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是()
A.25 ℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g·cm-3
查看答案和解析>>
科目: 来源: 题型:
下列变化规律错误的是
A.微粒半径:F-<Cl-<Br-<I- B.稳定性:HI<HBr<HCl<HF
C.沸点:HF<HCl<HBr<HI D.阴离子还原性:F-<Cl-<Br-<I-
查看答案和解析>>
科目: 来源: 题型:
某溶液中可能含有Cl-、I-、![]() 、
、![]() 、
、![]() 、
、![]() ,现进行如下实验:
,现进行如下实验:
(1)取部分溶液,加入过量Ba(NO3)2溶液,有白色沉淀生成,过滤出的沉淀部分溶于稀HNO3,并放出气体。
(2)取部分滤液,加入过量NaOH溶液,无沉淀产生。
(3)取部分滤液,加入AgNO3溶液,只有黄色沉淀生成。
根据上述现象,试判断:溶液中肯定存在的离子是____________,肯定不存在的离子是____________,可能存在的离子是____________。
查看答案和解析>>
科目: 来源: 题型:
有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于三支试管中进行实验。
(1)逐滴加入6mol·L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液;
(2)加热试管中的白色粉末,试管口有水滴凝结;
(3)逐滴加入6mol·L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管中还有白色不溶物。
下列混合物中符合以上实验现象的是( )
A.NaHCO3、AgNO3 B.BaCl2、MgCO3
C.NH4HCO3、MgCl2 D.CaCl2·6H2O、Na2Cl2
查看答案和解析>>
科目: 来源: 题型:
钛在地壳中的含量比铜多61倍,排第十位。钛及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域。
⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):

上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。
 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
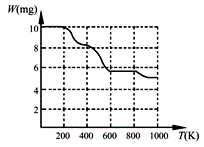
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
查看答案和解析>>
科目: 来源: 题型:
在硫酸的制备中,最后的产品是98%的硫酸或20%的发烟硫酸(H2SO4和SO3的混合物,其中SO3的质量分数为20%)。
(1)若98%硫酸可表示为SO3·aH2O,20%的发烟硫酸可表示为SO3·bH2O,则a、b的值(a、b可用分数表示)分别是:a= ,b= 。
(2)用m(H2O)=k·n(SO3)分别表示SO3转化成上述两种硫酸时,所用水的质量与SO3的物质的量的关系式(即求k)分别是:
m1(H2O)= n1(SO3),m2(H2O)= n2(SO3)。
(3)若工厂同时生产上述两种硫酸,则上述两种硫酸的质量比x(W1为98%的硫酸的质量、W2为20%的发烟硫酸的质量)与SO3的用量的物质的量之比y的关系是 。
查看答案和解析>>
科目: 来源: 题型:
硫酸盐的水合物多称“矾”,如CuSO4·5H2O,俗称胆矾。下面的硫酸盐与上面俗称有别的是
( )
①K2SO4·Al2(SO4)3·24H2O ②FeSO4·7H2O ③ZnSO4·7H2O ④Na2SO4·10H2O ⑤CaSO4·2H2O
A.①②③ B.②④⑤ C.③④ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com