
科目: 来源: 题型:
已知热化学方程式2H2(g)+ O2(g)== 2H2O(l) △H1 = —571.6kJ·mol-1,则关于热化学方程式“2H2O(l)== 2H2(g)+ O2(g) △H2 = ?”的说法正确的是( )
A.方程式中化学计量数表示分子数
B.该反应△H2大于零
C.该反应△H2= —571.6kJ·mol-1
D.该反应可表示36g 水分解时的热效应
查看答案和解析>>
科目: 来源: 题型:
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是 (填字母);

②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是 ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 ;
④该实验存在明显的缺陷,改进的方法是 。
(3)为测定漂白粉中Cs(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
下列实验操作不能达到其对应目的的是
| 编号 | 实验操作 | 目的 |
| A | 取 (水的密度近似看作1g/ | 配置4% |
| B | 滴定实验中,用待测液润洗锥形瓶 | 避免造成误差使滴定结果偏低 |
| C | 向 | 证明升高温度能促进 |
| D | 向盛有铜片的试管中加入浓硫酸,加热 | 证明浓硫酸具有强氧化性 |
查看答案和解析>>
科目: 来源: 题型:
16.如图a、b、C.d均为石墨电极,通电进行电解。
下列说法正确的是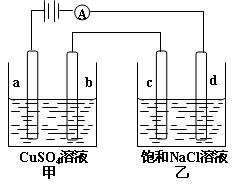
A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
B.电解时向乙中滴入酚酞试剂,C电极附近变红
C.向乙中通人适量HCl气体溶液组成可以恢复
D.当b极有64gCu析出时,C电极产生2g气体
查看答案和解析>>
科目: 来源: 题型:
(1)卤素单质F2、Cl2、Br2、I2的熔沸点由高到低排列为 ,理由是 。卤化氢HF、HCl、HBr、HI中,沸点最低为 ,最高为 ,造成的原因为 。
(2)晶体硼的熔点和硬度都介于金刚石和晶体硅之间。
①晶体硼的晶体类型属于 晶体,理由是 。
 ②如图,晶体硼的基本结构单元都是硼原子组成的正二十面体,其中含
②如图,晶体硼的基本结构单元都是硼原子组成的正二十面体,其中含
有20个等边三角形和一定数目的顶角,每个顶角上各有一个硼原子,
观察此图,试回答:
这个基本结构单元由 个硼原子组成,键角是 ,
共含有 个B—B键。
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入B g该盐,保持温度不变,析出R结晶水合物W g,从原饱和溶液中析出溶质R的质量为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。
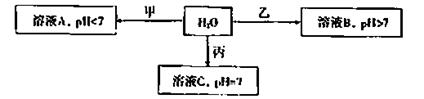
回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是 。
(2)①甲的化学式是 ,乙的化学式可能是 (写一种即可)
②若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是 。
若W2和Z-具有相同电子层结构,则乙的电子式是 。
(3)Y单质可用来制造Y—空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。
①若以溶液C为电解质溶液时,正极的反应式为 。
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为 。
查看答案和解析>>
科目: 来源: 题型:
在2KI+O3+H2O=2KOH+I2+O2的反应中,当有2摩尔的KI被氧化时,被还原的氧原子为
![]() A.1mol B.1
A.1mol B.1![]() /2mol C.2/3mol D.1/3mol
/2mol C.2/3mol D.1/3mol
查看答案和解析>>
科目: 来源: 题型:
 关于右图所示的原电池,下列说法正确的是
关于右图所示的原电池,下列说法正确的是
A.电子从铜电极通过检流计流向锌电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是![]()
查看答案和解析>>
科目: 来源: 题型:
物质的颗粒达到纳米级时,具有特殊的性质。如将单质铜制成“纳米铜”时,“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列叙述中正确的是
A.常温下,“纳米铜”比铜片的金属性强 B.常温下,“纳米铜”比铜片更易失电子
C.常温下,“纳米铜”与铜片的还原性相同 D.常温下,“纳米铜”比铜片的氧化性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com