
科目: 来源: 题型:
(1)分别用电子式表示HClO、MgCl2的形成过程
(2)已知下列原电池的总反应式:Cu+2FeCl3==CuCl2+2FeCl2,请写出电极反应式:
正极反应式为:
负极反应式为:
(3)如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是____________。(填序号)

查看答案和解析>>
科目: 来源: 题型:
下列关于第ⅠA族和第ⅡA族元素的说法正确的是( )
A.ⅠA族和ⅡA族的元素均为金属元素
B.在同一周期中,单质与水反应,ⅠA族比ⅡA族剧烈
C.单质的还原性,ⅠA族比ⅡA族强
D.ⅠA族与ⅡA族阳离子核外电子排布与同周期的稀有气体原子相同
查看答案和解析>>
科目: 来源: 题型:
设NA代表阿伏加德罗常数。下列说法正确的是
A.标准状况下,2.24 L NH3溶于l L水中得到0.1 mol/L的氨水
B.1mol 苯分子中含有碳碳双键数约为3×6.02×1023
C.0.4 mol乙炔和乙醛混合气体,在氧气中充分燃烧,消耗氧气的分子数为NA
D.500 mL 0.2 mol/L的K2S溶液中含有的离子总数为0.3 NA
查看答案和解析>>
科目: 来源: 题型:
|
|
乙:H2C2O4·2H2O CO↑+CO2↑+3H2O为判断甲、乙何者正确,在②之后还需补做的实验为 ( )
A.再验证剩余气体是否可燃及燃烧时火焰的颜色
B.将剩余气体还原热的CuO粉末,观察固体颜色的变化
C.将剩余气体通入溴水中,看溴水是否褪色
D.将剩余气体干燥后燃烧,再用无水硫酸铜检验燃烧产物
查看答案和解析>>
科目: 来源: 题型:
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是
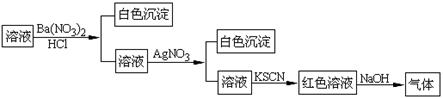
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
查看答案和解析>>
科目: 来源: 题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
![]() (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

![]() ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,![]()
![]() (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时![]() )
)
查看答案和解析>>
科目: 来源: 题型:
以石油裂解气为原料,通过一系列化学应可得到重要的化工产品增塑剂G。

(1)E是一种石油裂解气,能使酸性高锰酸钾溶液褪色。同温同压下,E的密度是H2的21倍。核磁共振氢谱显示E有3种不同化学环境的氢原子,其个数比为1:2:3。E的结构简式为 。
(2)反应类型:① ,④ 。
(3)反应条件:③ ,⑥ 。
(4)反应②、③的目的是 。
(5)反应⑤的化学方程式为 。
(6)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(7)G的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
有人建议将氢元素排在元素周期表的VII A族。下列事实能支持这一观点的是
①H原子得到一个电子实现最外电子层稳定结构
②氢分子的结构式为H-H
③与碱金属元素形成离子化合物M+[H]-
④分子中原子间的化学键都属于非极性键
A.只有①②③ B.只有①③④
C.只有②③④ D.全部
查看答案和解析>>
科目: 来源: 题型:
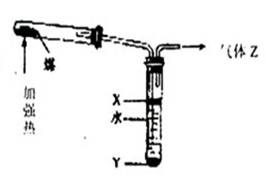 右图是实验室模拟煤的干馏的实验装置,下列有关叙述不正确的是( )
右图是实验室模拟煤的干馏的实验装置,下列有关叙述不正确的是( )
A.图示实验中发生了化学反应实验后水溶液的Ph〉7,
B.溶液Y是黑色粘稠的煤焦油,上层X是粗苯等气体
C.Z中有些成分易燃,且可以还原氧化铜溶液
D.Y是一种纯净物
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E为短周期元素,其原子序数依次增大。其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3 :2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲。A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。请回答:
(1)写出B元素在周期表中的位置 ,C单质的电子式是____________。
(2)A、D、E组成的化合物乙与氯化亚铁溶液反应的实验现象为 。
(3)常温下,甲的水溶液pH_______7(填>、<或=),其原因是(用离子方程式表示)_____________________。
(4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙 :丙= 。
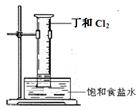
(5)A和B组成化合物丁,其相对分子质量为16。将右图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象。油状液滴的成分可能是(写分子式) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com