
科目: 来源: 题型:
水的电离平衡曲线如图所示:

(1)若以A点表示25 ℃时水在电离平衡时的离子浓度,当温度上升至100 ℃时,水的电离平衡状态到达B点,则此时水的离子积为_______________________________________。
(2)100 ℃时,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,欲使溶液的pH=7,则Ba(OH)2溶液与盐酸溶液的体积比为____________________________。
查看答案和解析>>
科目: 来源: 题型:
常温下,下列溶液中酸性最弱的是( )
A.pH=4 B.c(H+)=10-3 mol·L-1
C.c(OH-)=1×10-11mol·L-1 D.c(H+)/c(OH-)=1×104
查看答案和解析>>
科目: 来源: 题型:
下列各组数据关系,前者比后者大的是( )
A.纯水100 ℃和25 ℃时的pH
B.0.1 mol·L-1的盐酸与0.1 mol·L-1的醋酸的pH
C.100 mL 0.1 mol·L-1的CH3COOH溶液与10 mL 0.1 mol·L-1的CH3COOH溶液中的H+数目
D.0.1 mol·L-1的氨水中![]() 浓度与OH-浓度
浓度与OH-浓度
查看答案和解析>>
科目: 来源: 题型:
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 | HA的物质的量 浓度(mol·L-1) | NaOH的物质的量 浓度(mol·L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A— )和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]()
![]()
回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2— )+c(HB— )=0.1mol/L B.c( B2— )+ c(HB— )+c(H2B)=0.1mol/L
C c(OH— )=c(H+)+ c(HB— ) D.c(Na+)+c(OH)=c(H+)+ c(HB— )
查看答案和解析>>
科目: 来源: 题型:
设水的电离平衡线如图3-4所示:(1)若以A点表示20 ℃时水在电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点。则此时水的离子积______从增大到______。
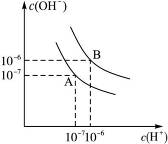
图3-4
(2)将100 ℃时pH=8的Ba(OH)2溶液与pH=5的稀H2SO4混合,并保持100 ℃的恒温。欲使混合液的pH=7,则Ba(OH)2与稀H2SO4的体积比为(二者混合后体积假设为二者体积之和)。
查看答案和解析>>
科目: 来源: 题型:
水的电离过程H2O![]() H++OH-,在不同温度下其离子积为KW(25 ℃)=1.0×10-14,KW(35 ℃)=2.1×10-14。则下列叙述正确的是( )
H++OH-,在不同温度下其离子积为KW(25 ℃)=1.0×10-14,KW(35 ℃)=2.1×10-14。则下列叙述正确的是( )
A.C(H+)随着温度的升高而降低 B.在35 ℃时,C(H+)>C(OH-)
C.水的电离常数K(25 ℃)>K(35 ℃) D.水的电离是一个吸热过程
查看答案和解析>>
科目: 来源: 题型:
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg![]() Cu
Cu![]() HgI
HgI![]() +2Cu(反应前后的I均为-1价)。
+2Cu(反应前后的I均为-1价)。
(1)上述反应产物Cu![]() HgI
HgI![]() 中,Cu元素显____________价。
中,Cu元素显____________价。
(2)以上反应中的氧化剂为______,氧化产物是_________,当有2个CuI参与反应时,转移电子________________个。
查看答案和解析>>
科目: 来源: 题型:
L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质,A、B分别代表两种含不同氯元素的物质(每种物质中,氮和氯元素的化合价只有一种);又知M中氮元素的化合价要比Q物质中氮元素的化合价低。在一定条件下,它们会发生如下的转化(未配平):
①P+A→Q+B ②L+O2→M+H2O ③L+M→R+H2O ④B+H2O→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是_______________________,理由是_____________________________________________________________________________。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为___________________________________________________________________。
(3)某学生写出下面三个含氮物质的相互转化的关系式:
(a)M+P→N2O3+H2O (b)N2O4+H2O→P+Q (c)M+L→Q+H2O
其中一定不可能实现的是____________,理由是____________________________________
______________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知反应式:①H2S+I2====S↓+2H++2I-
②H2SO3+2H2S====3S↓+3H2O ③2I-+Br2I2+2Br-④H2SO3+I2+H2O====![]() +2I-+4H+,下列各组中还原性由强到弱的是( )
+2I-+4H+,下列各组中还原性由强到弱的是( )
A.H2S、H2SO3、I-、Br-
B.I-、Br-、H2SO3、H2S
C.H2S、I-、Br-、H2SO3
D.I-、Br-、H2S、H2SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com