
科目: 来源: 题型:
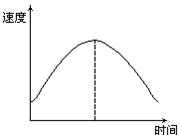 把镁条投入到盛有盐酸的敞口容器里,产生H2的速度可由图表示,在下列因素中,①盐酸的浓度②镁条的表面积③溶液的温度④Cl-的浓度,影响反应速度的因素是
把镁条投入到盛有盐酸的敞口容器里,产生H2的速度可由图表示,在下列因素中,①盐酸的浓度②镁条的表面积③溶液的温度④Cl-的浓度,影响反应速度的因素是
A.①④
B.③④
C.①②③
D.②③
查看答案和解析>>
科目: 来源: 题型:
用1L1.0mol·L-1NaOH溶液吸收0.8molCO2所得溶液中CO32-和HCO3-的物质的量浓度之比是
A.1∶3
B.2∶1
C.2∶3
D.3∶2
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是( )
A.硫酸分子中含有SO42- B.任何晶体中都含有化学键
C.含有阴离子的晶体一定是离子晶体 D.只含有极性键的分子一定为极性分子
查看答案和解析>>
科目: 来源: 题型:
锂和镁在元素周期表中有特殊的“对角关系”,它们的单质及其化合物性质相似,下列关于锂及其化合物的叙述中可能正确的是( )
A.Li2SO4难溶于水 B.LiOH加热时,不会分解
C.Li遇浓H2SO4发生钝化 D.Li2CO3加热时,分解成Li2O和CO2
查看答案和解析>>
科目: 来源: 题型:
有三种短周期元素,最外层电子数之和为17,质子数之和为31。如果这三种元素中有一种是氩元素,则关于另外两种元素的说法不正确的是( )
A.如果一种元素是金属元素,则另一种元素一定是稀有元素
B.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体
C.如果一种元素的气态氢化物是三角锥形分子,则另一种元素的气态氢化物一定是正四面体形分子
D.如果一种元素的最高正价是+3,则另一种元素的单质有两种常见的同素异形体
查看答案和解析>>
科目: 来源: 题型:
某石油液化气由丙烷和丁烷组成,其质量分数分别为80%和20%。已知:
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(g) ΔH=-2200kJ·mol-1
3CO2(g)+4H2O(g) ΔH=-2200kJ·mol-1
2C4H10(g)+13O2(g)![]() 8CO2(g)+10H2O(g) ΔH=-5800kJ·mol-1
8CO2(g)+10H2O(g) ΔH=-5800kJ·mol-1
现有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗0.056kg石油液化气,试计算该燃料的利用率。已知水的比热容为4.2kJ·kg-1·℃-1,铝的比热容为0.88kJ·kg-1·℃-1。
查看答案和解析>>
科目: 来源: 题型:
取1molA和amolB按如下反应进行:A(g)+aB(g) ![]() bC(g),当A的转化率为50%时,同温同压下,测得混合气体的密度是原来的4/3,则a、b可能是( )
bC(g),当A的转化率为50%时,同温同压下,测得混合气体的密度是原来的4/3,则a、b可能是( )
A.a=1,b=1 B.a=3,b=3
C.a=3,b=2 D.a=2,b=3
查看答案和解析>>
科目: 来源: 题型:
有一未知浓度的盐酸25 mL,在加入5 mol·L-1AgNO3溶液25 mL后,改加NaOH溶液,结果用去了1.0 mol·L-1NaOH溶液25 mL,恰好完全中和,则盐酸的物质的量浓度为
A.0.5 mol·L-1 B.1.0 mol·L-1
C.1.5 mol·L-1 D.2.0 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请完成下列问题:
(1)Na3N的电子式是_______________,该化合物由_______________键形成。
(2)Na3N与盐酸反应生成_______________种盐,其电子式分别是_______________。
(3)Na3N与水的反应属于_______________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)_______________(填“>”“=”或“<”)r(N3-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com