
科目: 来源: 题型:
下列物质分类的正确组合是
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯 碱 | 乙二酸 | 胆矾 | 氧化铝 | 二氧化碳 |
| B | 烧 碱 | 石炭酸 | 小苏打 | 氧化镁 | 一氧化碳 |
| C | 苛性钾 | 硬脂酸 | 萤石 | 过氧化钠 | 二氧化硫 |
| D | 苛性钠 | 油酸 | 苏打 | 氧化钠 | 三氧化硫 |
查看答案和解析>>
科目: 来源: 题型:
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
![]()
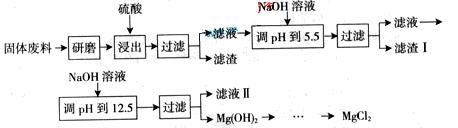
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
![]() 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
![]() (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
![]() (2)滤渣I的主要成分有 。
(2)滤渣I的主要成分有 。
![]() (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
![]() (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
![]() MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
![]() 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:![]()
![]()
![]()
![]()
![]()
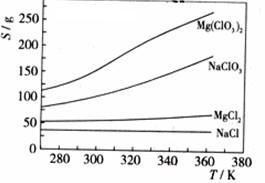
![]() ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
![]() ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
查看答案和解析>>
科目: 来源: 题型:
 下图是周期表中短周期的一部分,已知Y原子与Z原子核外电子总数为X原子核外电子数的4倍,以下推断正确的是( )
下图是周期表中短周期的一部分,已知Y原子与Z原子核外电子总数为X原子核外电子数的4倍,以下推断正确的是( )
A.X、Y、Z三者均为金属元素
B.X、Y、Z三者核外电子数之和为40
C.X与Y、Y与Z均可形成离子化合物
D.Y与Z只能形成一种共价化合物
查看答案和解析>>
科目: 来源: 题型:
将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:
KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O
(2)上式反应中的还原剂是 ,当还原剂失去1mol电子时,氧化产物的物质的量为 。
(3)a +b的最大值为 ,a +b最小值为 。
(4)当 a +b =0.18时,残留固体的质量为 。
查看答案和解析>>
科目: 来源: 题型:
下列叙述中正确的是 ( )
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失电子越多,还原性越强
D.强氧化剂与强还原剂不一定能发生氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
恒温、恒压下,在一个可变容积的容器中发生如下反应:
A(气)+B(气)![]() C(气)。
C(气)。
I(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为_______________mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为______mol。
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=________mol,y=________mol。平衡时,B的物质的量____________(选填一个编号)
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol
作出此判断的理由是__________________________。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是_________________。
II 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC.将b与(1)小题中的a进行比较__________(选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析正确的是
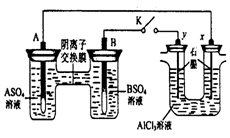
A.溶液中(A2+)浓度减小
B.B的电极反应:B-2eˉ=B2+
C.y 电极上有 H2 产生,发生还原反应
D.反应初期,x 电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式正确的是
A.硫化亚铁中加入稀硫酸 2H++S2-→H2S↑
![]()
![]() B.向苯酚钠溶液中通入少量的CO2 -O-+CO2+H2O→ -OH+HCO
B.向苯酚钠溶液中通入少量的CO2 -O-+CO2+H2O→ -OH+HCO![]()
C.向碳酸氢钠溶液中滴入少量石灰水 HCO![]() +Ca2++OH-→CaCO3↓+H2O
+Ca2++OH-→CaCO3↓+H2O
D.向明矾溶液中加入过量的氨水 A13++3NH3·H2O→Al(OH)3↓+3NH![]()
查看答案和解析>>
科目: 来源: 题型:
已知LiH、NaH及LiAlH4??都是常见的金属的氢化物,其中LiAlH4可由下列途径合成: 4LiH + AlCl3 ![]() LiAlH4+ 3LiCl。
LiAlH4+ 3LiCl。
试探究下列相关问题
(1)下列有关说法正确的是 ▲ 。
A.该反应是氧化还原反应
B.乙醚(C2H5OC2H5)是非极性分子
C.化学性质锂与镁相似,铝与铍相似
D.LiAlH4具有还原性
(2)正在载入...
镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构为:
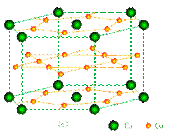
试回答下列问题
①在周期表中Ca处于周期表 ▲ 区。
②铜原子的基态核外电子排布式为: ▲ 。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n= ▲ (填数值);氢在合金中的密度为: ▲ 。
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60。非常适于实际应用。 Ca32C60上可吸附至少92个氢分子(如图)。

有关说法正确的是 ▲ 。
A.钙的第一电离能和电负性均比锶的第一电离能小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时, 储氢质量分数(wt%。)Ca32C60 比Sr32C60高
查看答案和解析>>
科目: 来源: 题型:
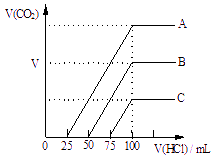 取等物质的量浓度的NaOH溶液A、B、C三等份各100 mL,分别向三份溶液中通入不等量的CO2气体,充分反应后,再向三份所得的溶液中逐滴加入0.2 mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸的体积之间的关系如图所示。试
取等物质的量浓度的NaOH溶液A、B、C三等份各100 mL,分别向三份溶液中通入不等量的CO2气体,充分反应后,再向三份所得的溶液中逐滴加入0.2 mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸的体积之间的关系如图所示。试![]() 回答下列问题:
回答下列问题:
(1)原NaOH溶液的浓度为 mol/L;
(2)曲线B表明,原NaOH溶液中通入的
CO2的体积为 mL ;
(3)曲线C表明,原NaOH溶液中通入CO2
后,所得溶液中的溶质成分的物质的量
之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com