
科目: 来源: 题型:
有机物(1)CH2OH(CHOH)4CHO(2)CH3CH2CH2OH(3)CH2=CH—CH2OH
(4)CH2=CH—COOCH3(5)CH2=CH—COOH中,既能发生加成、酯化反应,又能发生氧化反应的是
A.(3)(5) B.(1)(3)(5) C.(2)(4) D.(1)(3)
查看答案和解析>>
科目: 来源: 题型:
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:
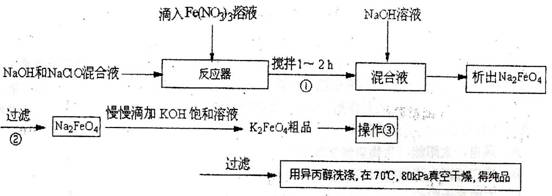
试回答下列问题
 (1)操作①搅拌的目的是:_______________________。
(1)操作①搅拌的目的是:_______________________。
(2)操作③名称是:______________________________。
(3)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为;_________。配制该质量浓度的溶液所需的玻璃仪器有:__________________。
(4)反应器中,NaOH、NaClO及Fe(NO3)3反应的化学方程式:
_____________________________________________________
查看答案和解析>>
科目: 来源: 题型:
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①: ▲ ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。
| 实验操作 | 实验现象或 预期实验现象 | 现象解释 (用离子方程式表示) | |
| 猜想② | ▲ | 溶液pH=8 | — |
| 向pH=2的硫酸中滴加Na2S2O3溶液 | ▲ | S2O32—+2H+=S↓+SO2↑+H2O | |
| 猜想③ | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | ▲ |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
⑴甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由 ▲ 。
⑵请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
如下图所示的物质的相互转变中,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应。常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。
 |
请回答下列问题:
(1)写出F的化学式: ;(2)写出G的电子式: ;
(3)反应①的化学方程式为 ;
人们将反应①所涉及的化学工业称为 ;
(4)反应⑤的离子方程式为 ;
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为
①Na2FeO4具有强氧化性可杀菌消毒
② 。
查看答案和解析>>
科目: 来源: 题型:
北京时间2008年2月21日上午11时26分,美国用导弹击毁了失控的卫星。美方称,卫星坠落地面时,燃料罐中装有的约453 kg联氨(N2H4),可能发生泄漏,造成伤害。
(1)联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
(2)联氨(N2H4)是航天飞船常用的高能燃料。联氨可用氨和次氯酸钠按一定物质的量之比混合反应生成联氨、氯化钠和水;该反应的氧化产物是 。也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式 。
(3)火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;
H2O(l)=H2O (g) DH=+44 kJ·mol-1
2H2O2(l)=2H2O(l)+ O2(g) DH=–196.4 kJ·mol-1
则写出表示联氨燃烧热的热化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
⑴目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于 。
 ⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①分解池中反应的化学方程式为 。
②在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
⑶李明同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。
李明应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
查看答案和解析>>
科目: 来源: 题型:
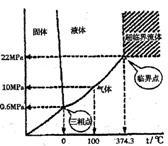 80年代中期美国学者Modell首次提出超临界水氧
80年代中期美国学者Modell首次提出超临界水氧
化技术(SCWO)。超临界流体(SCF)是指流体的温度和压
力处于它的临界温度(Tc)和临界压力(Pc)以上时的一种
特殊状态的流体,它具有许多独特的性质,如无机盐在超
临界水(SCW)中的溶解度很低。水的状态与压强、温度的
关系如右图。
(1)在380℃.20 MPa时,水的状态是 _______ ,若要使
之成为超临界水,必须采取的措施是 _______ 。
(2)以超临界水为介质,用氧气等氧化剂可将有机废物氧化成二氧化碳、氮气、水等无毒小分子。在超临界水中,偏二甲胼[(CH3)2NNH2]能迅速被H2O2氧化,写出该反应的化学方程式: _______
(3)SCWO基本工艺流程如下图所示:
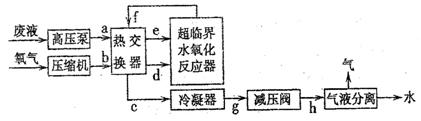
利用以上工艺流程处理某些含可溶性无机盐(只含钠盐、钾盐)的有机废水时,常常会出现管道堵塞现象,发生这种现象的原因是 _______ 。若检测到管道c中的流体的温度为287℃,管道e、d中的流体的温度为227℃,则上述a~h管道中易发生堵塞的管道为 _______ (填字母)。
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A.将![]() 通入
通入![]() 溶液中至饱和,无沉淀产生;再通入
溶液中至饱和,无沉淀产生;再通入![]() ,产生沉淀
,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入![]() 固体,铜粉仍不溶解
固体,铜粉仍不溶解
C.向![]() 溶液中滴加氨水,产生白色沉淀;再加入
溶液中滴加氨水,产生白色沉淀;再加入![]() 溶液,沉淀消失
溶液,沉淀消失
D.纯锌与稀硫酸反应产生氨气的速率较慢;再加入少量![]() 固体,速率不改变
固体,速率不改变
查看答案和解析>>
科目: 来源: 题型:
如右图所示,当关闭阀门K时,向甲中充入2molSO2和1molO2,在800℃时发生反应:

![]() .1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
.1min时反应达平衡状态,有3/4的SO2转化为SO3. 在800℃时,向乙中充入2molSO3.起始时,甲、乙的体积均为1L。下列说法正确的是( )
A.在800℃,若向甲的平衡体系中,再充入lmolS03气,达到薪平衡时,SO3的体积分数增大
B.800℃时,乙中反应达到平衡状态时,其气体体积小于1.125L
C若打开阀门K,新的平衡混合气中SO3的体积分数比打开K前甲、乙中的都大
D.800℃时,乙中反应![]() 的平衡常数为24
的平衡常数为24
查看答案和解析>>
科目: 来源: 题型:
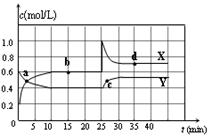 已知NO2和N2O4可以相互转化:2NO2(g)
已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化
N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化
关系如右图。下列说法正确的是
A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线
B.前10 min内用v(NO2)表示的化学反应速率为0.06 mol/(L·min)
C.25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L
D.a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com