
科目: 来源: 题型:
军事上的“地表伪装”是军事上保护的外观色彩、红外反射与环境吻合。BASF是新型红外伪装还原染料,为橄榄色或黑色,其化学结构如下:

1 mol该物质与钠在一定条件下反应,产生氢气量以及在催化剂作用下加成所需氢气物质的量,最大值分别为( )
A.1 mol,7 mol
B.2 mol,10 mol
C.1 mol,14 mol
D.2 mol,14 mol
查看答案和解析>>
科目: 来源: 题型:
实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1-溴丁烷时,还会有烯、醚和溴等副产物生成,反应结束后将反应混合物蒸馏,分离得到1-溴丁烷。已知有机物具有如下性质:
| 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
| 丁醚 | 95.3 | 142 | 0.76 |
| 1-丁烯 | -185.3 | -6.5 | 0.59 |
试完成下列问题:

(1)生成1溴丁烷的反应的化学方程式是______________________________________。
(2)反应中由于副反应而生成副产物的反应类型是______________________________。
(3)反应加热的温度应__________100 ℃(填“大于”“小于”或“等于”)
(4)反应结束时,从反应混合物中蒸馏得到1-溴丁烷时,应控制的温度范围是____________;选用的装置应是图中的__________ (填序号)。
(5)蒸馏得到的馏分中可能含有的杂质主要是__________,将其进一步除去的方法是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
每年的12月1日为世界艾滋病日,2005年世界艾滋病日的主题是“遏制艾滋,履行承诺”,2006年世界各国都加大了这方面的投入。最近,美国科学家发现半胱氨酸能增强对艾滋病毒感染的免疫力,对控制艾滋病的蔓延有奇效。已知半胱氨酸的结构简式为:![]() ,则下列说法错误的是( )
,则下列说法错误的是( )
A.半胱氨酸属于α-氨基酸
B.半胱氨酸是一种两性化合物
C.两分子半胱氨酸脱水形成的二肽结构简式为
![]()
D.![]() 可与NaOH溶液加热反应放出一种碱性气体
可与NaOH溶液加热反应放出一种碱性气体
查看答案和解析>>
科目: 来源: 题型:
有四种有机物:①纤维素,②环己烷,③苯,④乙酸。取等质量的上述有机物分别在过量氧气中完全燃烧,其耗氧量由大到小排列顺序为( )
A.①②③④
B.②③①④
C.④①③②
D.③④①②
查看答案和解析>>
科目: 来源: 题型:
下列实验操作或记录数据正确的是( )
A.用托盘天平称取16.85 g KClO3固体
B.过滤时,为了加快过滤速率,用玻璃棒不断搅拌
C.给试管中滴加液体时,滴管应竖直在试管口的正上方
D.用100 mL量筒量取92.18 mL稀硫酸
查看答案和解析>>
科目: 来源: 题型:
下图是实验室制备SO2并验证SO2某些性质的装置图。试完成下列问题:?
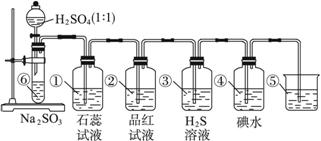
(1)⑥中发生的化学反应方程式为____________________________。?
(2)①中的实验现象为____________________________,此实验证明SO2是
____________________________气体。
(3)②中的品红溶液___________________________,证明SO2有
___________________________性。
(4)③中的实验现象是___________________________,证明SO2有
___________________________性。
(5)④中的实验现象是___________________________,证明SO2有
___________________________性。
(6)⑤的作用是___________________________,反应方程式为
___________________________。
查看答案和解析>>
科目: 来源: 题型:
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NAOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NAOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |

试回答下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是______________________________,不能用铜丝搅拌棒代替环形玻璃棒的理由是
__________________________________________________。
(2)经数据处理,t2-t1=3.4 ℃。则该实验测得的中和热ΔH=_________________________〔盐酸和NAOH溶液的密度按1 g·Cm-3计算,反应后混合溶液的比热容C按4.18 J·(g·℃)-1计算〕。
(3)若将NAOH溶液改为相同中体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1_______________ΔH(填“<”“>”或“=”=,理由是:_______________
______________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下列说法能够说明反应A(g)+B(g)![]() C(g)+D(g)在恒温下已达平衡的标志是( )
C(g)+D(g)在恒温下已达平衡的标志是( )
A.反应容器内的压强不随时间而变化 B.反应容器内的分子数不随时间的变化而变化
C.A、B的生成速率相等 D.B、C的生成速率相等
查看答案和解析>>
科目: 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g);△H=+QkJ??mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol??L-1,则H2的反应速率为0.03mol/(L??min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol??L-1的NaOH恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com