
科目: 来源: 题型:
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是 ( )
![]() A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO3、NaClO4
A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO3、NaClO4
查看答案和解析>>
科目: 来源: 题型:
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的 ( )![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
![]() B.使红色布条褪色(HCl)
B.使红色布条褪色(HCl)
![]() C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2)
![]() D.滴加AgNO3溶液生成白色沉淀(Cl-)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
查看答案和解析>>
科目: 来源: 题型:
下列物质按不同类别分组,所得组合最不合理的是( )
(1)糖类 (2)塑料 (3)石油 (4)蛋白质 (5)合成纤维 (6)棉花 (7)陶瓷 (8)玻璃
(9)天然气 (10)水泥 (11)合成橡胶 (12)煤 (13)油脂 (14)羊毛
A.(1)、(4)、(13) B.(2)、(5)、(11)
C.(7)、(8)、(10)、(14) D.(3)、(9)、(12)
查看答案和解析>>
科目: 来源: 题型:
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取
镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: 。

(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:![]()
![]()
![]()
![]()
![]()

![]()
![]()

| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合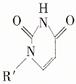 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:

①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异 。
查看答案和解析>>
科目: 来源: 题型:
以下物质的制备原理错误的是
A.无水氯化镁的制备:MgCl2·6H2O![]() MgCl2+ 6H2O
MgCl2+ 6H2O
B.钴的制备:3Co3O4+8Al![]() 9Co+4Al2O3
9Co+4Al2O3
C.烧碱的制备:2NaCl+2H2O![]() 2NaOH +H2↑+ Cl2↑
2NaOH +H2↑+ Cl2↑
D.漂粉精的制备: 2Ca(OH)2 + 2Cl2→Ca(ClO)2+CaCl2+2H2O
查看答案和解析>>
科目: 来源: 题型:
在基态多电子原子中,关于核外电子能量的叙述错误的是 ( )
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目: 来源: 题型:
1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) ![]() Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
(1)该反应的平衡常数表达式为____________________。
已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
![]() (2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(3)能说明该反应已达到平衡状态的是______(填序号)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(H2) = c(H2O) d.υ正(H2) =υ逆(H2O)
(4)向平衡体系中加入焦炭,下列图像正确的是___________(填序号)。
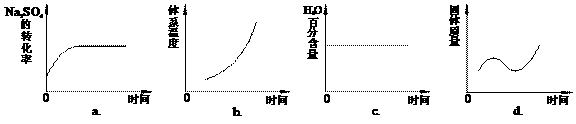
(5)用有关离子方程式说明上述反应产物水溶液的酸碱性______________________________,欲使该溶液中S2—浓度增大,平衡逆向移动,可加入的物质是____________________。
查看答案和解析>>
科目: 来源: 题型:
下列关于化学学科的认识说法错误的是
A.化学模型是对物质及其变化的简单化模拟,有助于解释一些化学现象
B.原子是化学变化中的最小微粒,通过复杂的化学反应可以产生新的元素
C.有电子转移的过程不一定能产生电流,但其化学反应一定是氧化还原反应
D.任何宏观物质都是由微观粒子构成,而这些粒子之间又存在着一定的作用力
查看答案和解析>>
科目: 来源: 题型:
将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是 ( )
A.反应过程中能得到6.72L的气体 B.最终得到的溶液中c(Na+)= c(Cl-) + c(OH-)
C.最终得到15.6g的沉淀 D.最终得到的溶液中c(NaCl)=1.5mol/L
查看答案和解析>>
科目: 来源: 题型:
|
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2 kJ??mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s) △H=—1473.2 kJ??mol-1
Ba(s)+S(s)=BaS(g) △H=—460 kJ??mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com