
科目: 来源: 题型:
反应2FeCl3+H2S====2FeCl2+S↓+2HCl改写为离子方程式,正确的是( )
A.2Fe3++S2-====2Fe2++S↓ B.Fe3++H2S====Fe2++S↓+2H+
C.2Fe3++H2S====Fe2++S↓+2H+ D.2FeCl3+S2-====2FeCl2+S↓+2Cl-
查看答案和解析>>
科目: 来源: 题型:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,若a 7(填>、<或=),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度![]() (A-)与
(A-)与![]() (Na+)的大小关系是 。
(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的![]()
![]() = mol·L-1。
= mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
下列关于稀有气体的叙述不正确的是( )
A.原子的最外层电子数都是8个电子
B.其原子与同周期IA、IIB族阳离子具有相同的核外电子排布
C.化学性质非常不活泼
D.原子半径比同周期VIIA族元素原子的大
查看答案和解析>>
科目: 来源: 题型:
(分)已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为: ,它的共价键属于 (填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为 。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:___________________ ______ ;
X与W形成的化合物与水反应时,水作的是 (填:氧化剂、还原剂)。
查看答案和解析>>
科目: 来源: 题型:
15. (10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量
Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为
97.0%~103.0%)的主要流程如下:
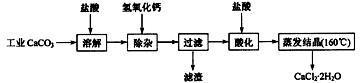 |
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量
Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量
Ca(OH)2 转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶
中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1 AgNO3 溶液
滴定至终点,消耗AgNO3 溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有: 。
②计算上述样品中CaCl2·2H2O的质量分数为: 。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可
忽略),其可能原因有: ; 。
查看答案和解析>>
科目: 来源: 题型:
列实验中,仪器的下端必须插入液面下的是
①分馏石油时的温度计; ②配制一定物质的量溶液定容时的滴管;
③制备Fe(OH)2操作中的胶头滴管; ④吸收SO2尾气时插入NaOH溶液的导管;
⑤制备氢气的简易装置中的长颈漏斗; ⑥制乙酸乙酯时插入饱和Na2CO3溶液的导管。
A. ①②⑥ C.③④⑤ B.③④⑤⑥ D.全部
查看答案和解析>>
科目: 来源: 题型:
再循环的工业社会废物严重危害环境及人类健康。现在产生的二氧化碳、家庭污水和其他“无毒”废物的速度超过了自然循环能够吸收它们的速度。我们正在不断地排放着有毒的(经常是不能生物降解的)废物,它们正积聚在土壤、空气和水中。后果是我们正在破坏着自然环境(如森林被毁、酸雨的形成和烟雾毁坏)、农业系统(如收成被土壤退化以及空气和水的污染所毁掉)和危害人类健康(如食物中残留的农药、人工合成聚合物造成的室内空气污染、室外的烟雾、被污染的饮用水以及有毒垃圾)。
请根据上述材料完成下列问题:
(1)文中关于污染与环境自净能力的关系可以表述为( )
A.环境污染速度超过环境自净能力
B.环境污染速度低于环境自净能力
C.环境污染速度与环境自净能力大体相当
(2)二氧化碳浓度增大会导致___________效应,对沿海地区的影响是__________________,对气候的主要影响是_________________________________。
(3)文中提到环境污染的后果主要是在___________、___________和___________三方面。
(4)除工业污染外,消费污染越来越严重,请列出四种主要消费污染___________________。
查看答案和解析>>
科目: 来源: 题型:
普通玻璃中含13%的Na2O、11.7%的CaO、75.3%的SiO2,用氧化物的形式表示普通玻璃组成的化学式是( )
A.Na2O·2CaO·6SiO2 B.2Na2O·CaO·6SiO2
C.Na2O·CaO·6SiO2 D.Na2O·2CaO·SiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com