
科目: 来源: 题型:
用NA代表阿伏加德罗常数,下列说法正确的是
A.0.5molAl与足量盐酸反应转移电子数为1NA
B.标准状况下,11.2LSO3所含的分子数为0.5NA
C.0.1molCH4所含的电子数为1NA
D.46gNO2和N2O4的混合物含有的分子数为1NA
查看答案和解析>>
科目: 来源: 题型:
一密闭容器中盛有甲烷,在隔绝空气条件下长时间加热到1 000 ℃左右,然后恢复至室温(20 ℃)。这时容器内气体的压强是原来甲烷压强的m倍,原来甲烷的密度是容器内气体密度的n倍。下列判断正确的是( )
A.m=2,n=4 B.m=0.5,n=4
C.m=2,n=0.25 D.m=0.5,n=0.25
查看答案和解析>>
科目: 来源: 题型:
甲烷和氧气的混合气体57 mL,点火爆炸后(氧气过量),剩余气体为23 mL(气体体积均在室温和1.01×105 Pa下测定)。求混合气体中有多少亳升甲烷?
查看答案和解析>>
科目: 来源: 题型:
科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:
CO2+______________H2![]() ______________+2H2O
______________+2H2O
查看答案和解析>>
科目: 来源: 题型:
按系统命名法,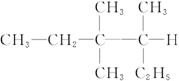 的正确名称是( )
的正确名称是( )
A.3,3-二甲基-4-乙基戊烷 B.3,4-二甲基-4-乙基戊烷
C.2,3,3-三甲基戊烷 D.3,3,4-三甲基己烷
查看答案和解析>>
科目: 来源: 题型:
下列说法中正确的是( )
A.式量相同的物质是同种物质 B.分子式相同的不同有机物一定是同分异构体
C.具有同一通式的物质属于同系物 D.分子中含有碳与氢的化合物是烃类
查看答案和解析>>
科目: 来源: 题型:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是![]()

![]()
![]()

![]()
![]() A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
![]()
![]() B.在H2O2分解过程中,溶液的pH逐渐下降
B.在H2O2分解过程中,溶液的pH逐渐下降
![]()
![]() C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
![]()
![]() D.H2O2生产过程要严格避免混入Fe2+
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
科目: 来源: 题型:阅读理解
 工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl,![]() 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是 。
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
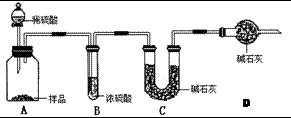
甲:用 (填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是 。
乙:准确称取10.00g样品后,用 (填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 | 计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 |
| 失 败 | |
| 乙 |
|
| |
| 丙 |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com