
科目: 来源: 题型:
漂白粉在生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
(1)1998年,我国长江流域和松花江流域都发生了百年不遇的特大洪水。灾区人们的饮用水,必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会失效。试用化学方程式表示漂白粉在空气中易失效的原因:① ;② 。
(2)已知浓盐酸和次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)![]() CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是()
①CO2 ②HCl ③H2O ④O2
A.①②③ B.②③④ C.②③ D.①④
(3)用Cl2和石灰乳制作漂白粉的目的是()
A.转变为较HClO稳定且易储运的物质
B.转变为更易溶于水的物质
C.提高氯气的利用率
D.增强漂白能力
查看答案和解析>>
科目: 来源: 题型:
在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断未知液中含有( )
A.Cl-、![]() B.Cl-、
B.Cl-、![]() C.Cl-、
C.Cl-、![]() D.Cl-、OH-
D.Cl-、OH-
查看答案和解析>>
科目: 来源: 题型:
实验室用二氧化锰和浓盐酸来制取氯气,最好的实验操作顺序是( )
①将烧瓶固定在铁架台上 ②把酒精灯放在铁架台上,根据酒精灯确定铁圈高度,固定铁圈放好石棉网 ③用药匙向烧瓶中加二氧化锰,再向分液漏斗中加入浓盐酸,并将导气管放入集气瓶中 ④检查装置的气密性 ⑤在烧瓶上装好分液漏斗,连接好导气管
A.②③④①⑤ B.②①④③⑤
C.②①⑤④③ D.②①③④⑤
查看答案和解析>>
科目: 来源: 题型:
下列关于硅的说法不正确的是
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定程度时,硅能与氧气、氢气等非金属反应
查看答案和解析>>
科目: 来源: 题型:
![]() A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
![]() (1)B元素的原子结构示意图为: ;
(1)B元素的原子结构示意图为: ;
![]() (2)由A、B、C三元素可以组成盐X,X中存在的化学键类型是: ;
(2)由A、B、C三元素可以组成盐X,X中存在的化学键类型是: ;
![]() (3)E是非金属元素,但能表现出一些金属元素的性质,请写出E与D元素的最高价氧化物的水化物反应的离子方程式: ;
(3)E是非金属元素,但能表现出一些金属元素的性质,请写出E与D元素的最高价氧化物的水化物反应的离子方程式: ;
![]() E、B两元素在一定条件下可合成用于制造轴承、永久模具的新型无机非金属材料,该材料的化学式为 ,其晶体类型是 晶体;
E、B两元素在一定条件下可合成用于制造轴承、永久模具的新型无机非金属材料,该材料的化学式为 ,其晶体类型是 晶体;
![]() (4)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体[已知n(A)∶n(B)=3∶1],可放出18.44kJ热量,则该反应的热化学方程式: 。
(4)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体[已知n(A)∶n(B)=3∶1],可放出18.44kJ热量,则该反应的热化学方程式: 。
![]() (5)F、C分别与A形成的化合物的熔、沸点A2F A2C(填“>”“<”或“=”)。
(5)F、C分别与A形成的化合物的熔、沸点A2F A2C(填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多l,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀。各物质间的转化关系如下图所示(反应条件多数已略去);
请回答:
(1)反应⑥的离子方程式是
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是
(3)在反应①中,已知lgB,完全燃烧生成液态D时,放出142.9KJ的热量,则表示B燃烧热的热化学方程式是
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是
(5)反应③④在通常情况下不能自发进行,框图中的条件a是 ,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式
查看答案和解析>>
科目: 来源: 题型:
(经典回放)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
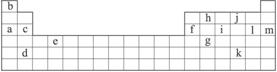
(1)下列____________(填写编号)组成元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、i ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子所需的能量远远大于失去第1个电子所需的能量。_____________________________。
②表中X可能为以上13种元素中的_______________ (填写字母)元素。用元素符号表示X和j形成化合物的化学式:__________________。
③Y是周期表中_______________族元素。
④以上13种元素中,_______________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、R分别代表4种元素。a、b、c、d分别是aXm+、bYn+、cZm-、dRn-离子的核电荷数,已知aXm+、bYn+、?cZm-、dRn-离子具有相同的电子层结构,则下列关系正确的是( )
A.a-c=2n B.a-b=n-m C.c-d=m+n D.b-d=2n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com