
科目: 来源: 题型:
下列化学用语表示正确的是 ( )
A.氯化钠的电子式为![]()
B.次氯酸的电子式![]()
C.二氧化碳的结构式为O=C=O
D.NaHCO3的电离方程式为NaHCO3=Na++H++CO32-
查看答案和解析>>
科目: 来源: 题型:
(分)高铁酸钾是一种重要的水的处理剂,实验可用下列流程制取高铁酸钾,

⑴NaClO溶液中加入NaOH固体形成碱性环境。
⑵将研磨的Fe(NO3)3 少量多次的加入到上述溶液中,冰浴中反应1h。
采用少量多次加入,其目的是___________________________;该反应的离子方程为:
_____________________________________。
⑶将KOH加入到反应后的溶液搅拌半小时。静置,抽滤的粗产品。该反应的化学方程式为:_____________________________。
⑷依次用甲苯、乙醇、乙醚洗涤以除去水份和KNO3、KCl、KOH等杂质。
⑸在强碱性溶液中,高铁酸钾能将亚铬酸盐(KCrO2)氧化为铬酸盐(K2CrO4),生成的铬酸盐溶液酸化后,得到的重铬酸钾(K2Cr2O7)用Fe(Ⅱ)的标准溶液滴定,以二苯胺磺酸钠为指示剂。到达滴定终点时,溶液由紫色变为淡绿色。现称取5.000 g高铁酸钾样品于烧杯中,加入适量氢氧化钾溶液,加入稍过量的KCrO2,充分反应后,转移到250 mL容量瓶中,定容,量取25.00mL,再用稀硫酸酸化,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,用去标准溶液33.33 mL。
①滴定时适宜选用的滴定管是: (a、酸式,b、碱式)。
②计算上述实验制得的样品中,高铁酸钾的质量分数为_________________。
③若上述过程中,测得的样品中高铁酸盐的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________ 。
查看答案和解析>>
科目: 来源: 题型:
硫与热强碱溶液可生成S2-和SO32-;生成物继续与硫作用得Sz2-和S2O32-。过滤后除去过量硫,向滤液中加入一定量的强碱后,再适入足量的SO2,SO2与Sz2-也完全转化为S2O32-。问:
(1)![]() S+SO2+OH-完全转化为S2O32-的离子方程式____________________
S+SO2+OH-完全转化为S2O32-的离子方程式____________________
(2)![]() amolS最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
amolS最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
(3)![]() 若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为
若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为
![]() _________。
_________。
查看答案和解析>>
科目: 来源: 题型:
(分)已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它会自动脱去一分子水生成含有羰基的化合物。化合物A为苯的同系物,aL A的蒸汽完全燃烧消耗相同状况下O2 9aL。关于A的一系列转化关系如图所示。

其中C能发生银镜反应,并且C在浓碱条件下可以发生自身氧化还原反应生成E和F。回答有关问题
(1)反应①②③④⑤中,属于取代反应的有___________________(填序号)。
(2)B是反应①的产物之一,写出反应①其他可能的产物的结构简式__________________。
(3)写出反应③的化学方程式_____________________________,
写出反应④的化学方程式_____________________________________。
(4)G属于酯类的同分异构体有______种(不包含G),写出其中任意2种的结构简式____________。
查看答案和解析>>
科目: 来源: 题型:
某氧化铝样品中含有氧化铁和二氧化硅杂质,(二氧化硅不溶于盐酸)现欲制取纯净的氧化铝,某同学设计如下的实验方案。回答下列问题:
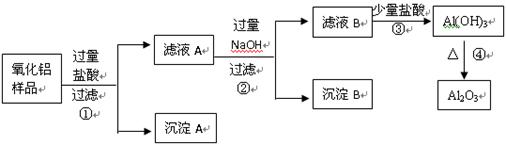
(1)沉淀A的化学式是________________,沉淀B的化学式是________________,滤液A中含有的阳离子为 和 ,滤液B中的含铝元素的化合物化学式是_________ ____;
(2)步骤②中,加过量的氢氧化钠发生的两个反应用化学方程式表示为:
,
。
(3)步骤③的离子方程式为 。
若所加的盐酸为过量,又能发生的反应的化学方程式为:
。
(4)在操作②中要用到的玻璃仪器有 、___________、__________。
(5)步骤④的反应化学方程式为_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
《环球科学》2009年第9期: 高温超导 “铁”的飞跃,对铁基超导体的研究寻找室温超导体提供线索。下列有关铁及其化合物的说法不正确的是( )
A.铁元素在周期表的位置是第四周期第ⅦB族
B.常温下,铁不与浓硫酸或浓硝酸的反应
C.铁与水蒸汽在高温下的反应产物为Fe2O3和H2
D.可以用化合反应制备Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
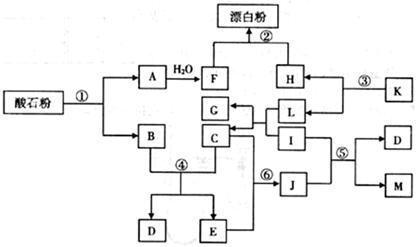
酸石粉主要成分为CaCO3。在下图各物质的相互转化中,K、I、J是日常生活中的调味剂,I、J、M、G为有机物,Mr(J)=60,Mr(M)=88,反应①②③均是工业生产中的重要反应。
请回答下列问题:
(1)K的化学式: ,J的分子式: 。
(2)反应①中,含10g CaCO3的酸石粉,在![]() ℃、
℃、![]() kPa时,完全分解生成A(s)和B(g),吸引a kJ热量(杂质不反应),该反应的热化学方程式为 。
kPa时,完全分解生成A(s)和B(g),吸引a kJ热量(杂质不反应),该反应的热化学方程式为 。
(3)反应④的化学平衡常数的表达式:K= ,已知![]() 则该反应是 反应(填“吸热”或“放热”)。
则该反应是 反应(填“吸热”或“放热”)。
(4)反应⑤的化学方程式为 。
(5)反应⑥生成J,符合绿色化学原则的原因是 。
查看答案和解析>>
科目: 来源: 题型:
随着高科技的发展,新型产品不断涌现,在今年全国两会初次亮相的用碳酸钙制取的“石头纸”就是其中之一。下列关于“石头纸”![]() 的叙述中正确的是
的叙述中正确的是
①它不溶于水、可反复使用 ②原材料为矿物质,密度大于普通纸
③该产品原料为植物纤维、密度比普通纸小 ④生产工艺不使用强酸、强碱
⑤该产品韧性大、防潮,可降解是良好的环保产品
A. ①②③④⑤ B. ①②④⑤ ![]() ③④⑤ D. ①③④⑤
③④⑤ D. ①③④⑤
查看答案和解析>>
科目: 来源: 题型:
下列各组物质,用一种试剂无法区别的是( )
A.三种浓酸:HNO3、H2SO4、HCl
B.四种黑色粉末:FeO、Fe、CuO、C
C.四种无色溶液:NaCl、NaOH、KOH、KCl
D.四种白色粉末:(NH4)2SO4、NH4Cl、Na2??SO4、NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com