
科目: 来源: 题型:
下列叙述正确的是
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价
查看答案和解析>>
科目: 来源: 题型:
下列各种情况下,溶液中可能大量存在的离子组是
A.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、OH-、NO3-
B.澄清透明的溶液中:I-、Cl-、ClO-、Na+
C.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-
D.含有S2O32-的溶液中:K+、Na+、SO32-、SO42-
查看答案和解析>>
科目: 来源: 题型:
有一工业烧碱(含氯化钠),现要求采用学过的定量实验的方法测定此工业烧碱中氢氧化钠的质量分数(假设各步实验中试样的损失忽略不计),请完成如下实验报告。
实验报告
(一) 实验目的:工业烧碱中氢氧化钠的质量分数测定
(二) 实验原理:(写出有关离子反应方程式):_____________________________,
(三) 实验试剂:工业烧碱、标准浓度的盐酸、甲基橙。
(四) 实验仪器:铁架台(成套)、天平、烧杯、锥形瓶、移液管、胶头滴管、100ml量筒、 ________、_______。
(五) 按实验顺序填写实验步骤: (中和滴定法)
______、溶解、移液管量取一定体积的待测液于洁净的锥形瓶中、__________、用标准盐酸滴定至终点。
当滴定至溶液由______色变为_____色,且半分钟不腿色时停止滴定。在相同条件下重复二次。
(六)数据处理及问题讨论:
1、若要测定样品中氢氧化钠的质量分数,实验中至少需要测定那些实验数据?_______________________________________。
2、取a克样品,配置100mL溶液,取20mL待测液,用C mol/L的标准盐酸滴定至终点,消耗盐酸VmL。试写出样品中氢氧化钠的质量分数表达式为: 。
查看答案和解析>>
科目: 来源: 题型:
天然蛋白质水解产物中含某有机物A,A由C、H、N、O元素组成。A能与NaOH反应,也能与盐酸反应。在一定条件下两分子A发生缩合反应生成有机物B和1个水分子,B的相对分子质量为312,当蛋白质与浓硝酸反应时显黄色。由此推断A的结构简式为________________________,B的结构简式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
下列反应的离子方程式正确的是( )
A.向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-==2H2O+BaCl2
B.往FeCl3溶液中加入Fe粉:2Fe3++Fe ==3Fe2+
C.往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2==CaCO3↓+H2O
D.往FeCl3溶液中加入Cu粉:Fe3++Cu==Fe2++Cu2+
查看答案和解析>>
科目: 来源: 题型:
由一价离子组![]() 成的四种盐:AC、BD、AD、BC的1 mol·L-1的溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则 ( )
成的四种盐:AC、BD、AD、BC的1 mol·L-1的溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则 ( )
| A | B | C | D | |
| 碱性 | AOH>BOH | AOH<BOH | AOH>BOH | AOH<BOH |
| 酸性 | HC>HD | HC>HD | HC<HD | HC<HD |
查看答案和解析>>
科目: 来源: 题型:
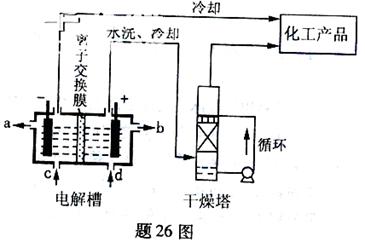
工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
![]() (1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。
(1)题26图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() (2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。
![]() ①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为 。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为 。
![]() ②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
![]() 3 SiCl4(g)+2H2(g)+Si(s)
3 SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g)
4SiHCl3(g)
![]() 达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 kg。
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 kg。
![]() (3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气 ![]() (标准状况)。
(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
I2在KI溶液中存在下列平衡:
![]()

![]()
![]()
![]()
![]()
![]()
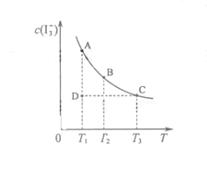
![]() 某I2、、KI混合溶液中,
某I2、、KI混合溶液中,![]() 的物质的量浓度c(
的物质的量浓度c(![]() )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 ( )
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 ( )
![]()
![]()
![]()
![]() A.反应
A.反应![]()
![]()
![]() 的△H>0
的△H>0
![]()
![]() B.若温度为
B.若温度为![]() ,反应的平衡常数分别为
,反应的平衡常数分别为![]()
![]()
![]() C.若反应进行到状态D时,一定有
C.若反应进行到状态D时,一定有![]()
![]()
![]() D.状态A与状态B相比,状态A的c(I2)大
D.状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目: 来源: 题型:
(4分)在适当的温度和压强下,4体积的某气态化合物完全分解后产生1体积磷蒸气和6体积的氢气,由此可推断该气态化合物的分子式为______,该分解反应的化学方程式为____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com