
科目: 来源: 题型:
将Na2O2 与NaHCO3 的混合物置于密闭容器中,加热后排放出气体,容器内残留固体可能为( )
A、NaHCO3 与NaOH B、NaHCO3 与Na2CO3
C、Na2CO3 或Na2CO3 与NaOH 的混合物 D、Na2O2 与NaOH
查看答案和解析>>
科目: 来源: 题型:
将SO2和O2以体积比为1:3混合后,通入接触室发生反应2SO2(g)+O2(g) ≒ 2 SO3(g), 达平衡时,在同温、同压下测得反应前与反应后混合气体的密度之比为71:80。求SO2的转化率?并回答SO2接触氧化为SO3时不采取加压措施的原因。
查看答案和解析>>
科目: 来源: 题型:
2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是高考资源网
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是高考资源网
![]() A.催化剂V2O5不改变该反应的逆反应速率高考资源网
A.催化剂V2O5不改变该反应的逆反应速率高考资源网
![]() B.增大反应体系的压强,反应速率一定增大高考资源网
B.增大反应体系的压强,反应速率一定增大高考资源网
![]() C.该反应是放热反应,降低温度将缩短反应达到平衡的时间高考资源网
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间高考资源网
![]() D.在t1、l2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为
D.在t1、l2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为![]() 高考资源网
高考资源网
查看答案和解析>>
科目: 来源: 题型:
某学生课外活动小组利用右图所示装置分别做如下实验:

(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
查看答案和解析>>
科目: 来源: 题型:
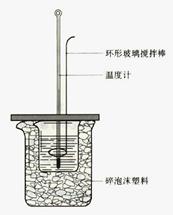 实验室用50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
实验室用50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
⑴大小烧杯间填满碎泡沫塑料的作用是 。
⑵ (填“能”或“不能”)将环形玻璃搅拌棒改为环形金属
(如铜)棒。其原因是 。
⑶大烧杯上如不盖硬纸板,对求得中和热数值的影响
是 (填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1
氢氧化钠溶液进行反应,则与上述实验相比,所放热
量 (“增加”、 “减少”或“不变”),理由是 ;
所求中和热数值 (“增加”、“减少”或“不变”),理由是 。
查看答案和解析>>
科目: 来源: 题型:
下列有关碱金属元素及其化合物的叙述:①碱金属元素的次外层电子数是2或8,②碱金属元素位于元素周期表的第IA族 ③ 碱金属的氯化物都是强电解质;④碱金属最高价氧化物的水化物都是强碱,其中正确的
A.只有② B.只有④ C.只有①②④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com