
科目: 来源: 题型:
1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50 MPa的高压和500 ℃的高温下,用铁作催化剂,且氨转化率10%—15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2![]() 2NH3,有关说法正确的是( )
2NH3,有关说法正确的是( )
A.不同的催化剂对化学反应速率影响均相同
B.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.哈伯法合成氨是吸热反应,新法合成氨是放热反应
查看答案和解析>>
科目: 来源: 题型:
绿色化学对于化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯(![]() )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
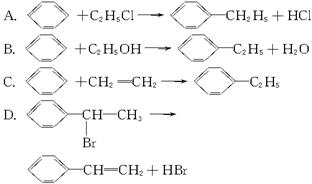
查看答案和解析>>
科目: 来源: 题型:
CO不仅是家用煤气的主要成分,也是重要的化工原料。下图是用某些简单有机物在低温、低压和催化剂存在下合成具有优良性能的装饰性高分子涂料、黏胶剂的基本过程。
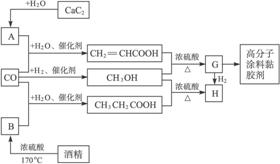
已知CaC2与水反应的化学方程为CaC2+2H2O![]() Ca(OH)2+HC≡CH↑。回答下列问题:
Ca(OH)2+HC≡CH↑。回答下列问题:
(1)写出G的结构简式。
(2)写出图中生成CH3OH(甲醇)的化学方程式。写出在浓硫酸作用下生成H的化学方程式。
(3)指出上述工艺的优点是什么?
查看答案和解析>>
科目: 来源: 题型:阅读理解
先阅读以下信息:
①烷基是烷烃去掉1个或几个氢原子后的剩余部分,如—CH3叫做甲基,—C2H5或—CH2CH3叫做乙基……以下是几种常见烷基的种数:
| 烷基名称 | 甲基 | 乙基 | 丙基 | 丁基 | 戊基 | 己基 |
| 种数 | 1 | 1 | 2 | 4 | 8 | 17 |
②—CH2OH可被氧化为—CHO。如果羟基所在的碳原子上没有或只有1个氢原子,则该羟基不能被氧化为醛基。
然后回答:有多少种己醇可被氧化为醛( )
A.8种 B.10种 C.11种 D.17种
查看答案和解析>>
科目: 来源: 题型:
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4,1 mol A的单质与盐酸反应可置换出11.2 L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)A是________元素,B是________元素,C是________元素。
(2)分别写出A、B最高价氧化物对应的水化物分别与C的气态氢化物水溶液反应的离子方程式________________________。
查看答案和解析>>
科目: 来源: 题型:
第ⅣA族元素R,在它的化合物R(OH)n中,R的质量分数为77.8%;在它的另一种化合物R(OH)m中,R的质量分数为63.6%。试求:
(1)n和m的值。
(2)R的相对原子质量。
查看答案和解析>>
科目: 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体,HAt不稳定
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)比H2S稳定
查看答案和解析>>
科目: 来源: 题型:
天然钫(Fr)极微量,它的21个已知同位素都有放射性,它是碱金属元素中最重要的元素,根据它在周期表中的位置预言其性质,其中不正确的是( )
A.在已知元素中它具有最大的原子半径
B.在空气中燃烧时,生成氧化物Fr2O
C.氧化物的水化物是极强的碱
D.单质的熔点比钠的熔点高
查看答案和解析>>
科目: 来源: 题型:
GaAs是仅次于硅的一种新型化合物半导体材料,其性能比硅更优越。Ga、As分别位于元素周期表的第ⅢA族、第ⅤA族。
(1)Ga原子和As原子最外层的电子数分别是多少?
(2)GaAs中Ga和As的化合价分别是多少?
(3)第ⅣA族的C和Si也可以形成与GaAs类似的化合物,该化合物也能用作半导体材料。试推断该化合物的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com