
科目: 来源: 题型:
![]() 下表列出了前20号元素中的某些元素性质的有关数据:
下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号w.w.^w.k.&s.5*u.c.#om 元素性质 | ① w.w.^w.k.&s.5*u.c.#o | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩[来源:学 |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3[ | -1[ |
试回答下列问题(注:所有非金属元素均有负价):
(1)以上10种元素的原子中,最易失去电子的是 __(填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)__________________,固态时形成 晶体。
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于___________ ___ 。
(4)若物质Na2R3是一种含有非极性共价键的离子化合物,请写出该化合物的电子式_________________________,属于 晶体。
查看答案和解析>>
科目: 来源: 题型:
做实验时不小心沾了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4—+C2O42—+H+ → CO2↑+Mn2++ ,关于此反应的叙述正确的是( )
A.该反应的氧化剂是C2O42— B.该反应右边横线上的产物是OH—
C.该反应电子转移总数为5e— D.配平该反应后,H+的化学计量数是16
查看答案和解析>>
科目: 来源: 题型:
原子数相同、电子总数相同的粒子,互称为等电子体。硼元素可形成三个等电子体阴离子:BO2-、BC25-和BN2n-,则BN2n-中的n值为
A.1 B.2 C.3 D.4
查看答案和解析>>
科目: 来源: 题型:
下列叙述中,正确的是:
A.IA族元素,其原子半径越大金属性越弱
B.核外电子排布相同的两种微粒,化学性质一定相同
C.氨基酸具有两性,则多肽及由多肽形成的蛋白质均具有两性
D.苯分子具有不饱和性,苯与乙炔一样都可使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目: 来源: 题型:
关于下图所示各装置的叙述中,正确的是 ( )

A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B.装置①中,铁做负极,电极反应式为:Fe3++e-=Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目: 来源: 题型:
研究性学习小组进行SO2的制备及性质探究实验。
![]() (1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2??+H2O,制备SO2气体。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2??+H2O,制备SO2气体。
![]() ①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
![]()
![]() ②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。
![]() (2)将SO2气体分别通入下列溶液中:
(2)将SO2气体分别通入下列溶液中:
![]() ①品红溶液,现象是 ;
①品红溶液,现象是 ;
![]() ②溴水溶液,现象是 ;
②溴水溶液,现象是 ;
![]() ③硫化钠溶液,现象是 。
③硫化钠溶液,现象是 。
![]() (3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
![]() ①原因 ,验证方法 。
①原因 ,验证方法 。
![]() ②原因 ,验证方法 。
②原因 ,验证方法 。
![]() ③原因 ,验证方法 。
③原因 ,验证方法 。
查看答案和解析>>
科目: 来源: 题型:
(分)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质且利用率较高。合成路线如下:
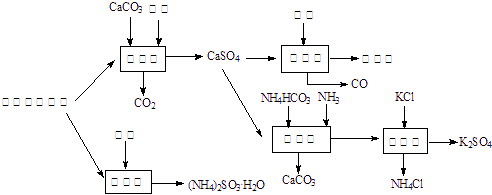
⑴生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
⑵下列有关说法正确的是_______________。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C![]() CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60~70 ℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
⑶反应Ⅴ反应液用40%乙二醇溶液,温度控制在25 ℃,硫酸钾的产率超过90%,其原因是_________________________。
⑷(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,若某尾气含标准状况试写出二氧化氮与亚硫酸铵反应的化学方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:
过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化钙样品的组成,进行了如下实验。
① 称取0.270 g样品,灼热使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下体积为33.6 mL。
② 另取0.120 g样品,溶于稀盐酸,加热煮沸,使生成的H2O2完全分解。然后将溶液中的Ca2+ 完全转化为CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200 mol·L-1 KMnO4溶液滴定,共用去31.0 mL KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4 = K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
(1) 写出CaO2受热分解的化学方程式。
(2) 计算样品中CaO2的质量分数。
(3) 计算样品中CaO2·x H2O的x值。
查看答案和解析>>
科目: 来源: 题型:
美以三位科学家因“对核糖体结构和功能的研究”而获2009年诺贝尔化学奖,核糖体是进行蛋白质合成的重要细胞器;美国三位科学家因研究“染色体如何受到端粒和端粒酶的保护”而获2009年诺贝尔生理或医学奖。下列有关蛋白质的说法正确的是
A.蛋白质中一定含有C、H、O、P B蛋白质是人生命活动中最主要的能量物质
C.酶也是一种蛋白质 D蛋白质都能水解生成产物是一种氨基酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com