
科目: 来源: 题型:
某厂废水中含5.00×10-3mol·L-1的![]() ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料![]() (
(![]() 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:

(1)第①步反应的离子方程式是
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(4)欲使1L该废水中的![]() 完全转化为
完全转化为![]() 。理论上需要加入
。理论上需要加入
GFeSO4·7H2O。
查看答案和解析>>
科目: 来源: 题型:
向25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示。下列有关溶液中粒子浓度关系的描述中,正确的是( )

A.在A、B间任一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点:a =12.5,且有c(Na+)=c(CH3COO-)
C.在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
查看答案和解析>>
科目: 来源: 题型:
科学实验证明通常状态下并不存在NaAlO2,Al(OH)3溶于强碱溶液形成的阴离子实际是因为Al(OH)3分子中的铝原子最外层电子数未达到饱和,能与OH-离子形成配位键,结合生成[Al(OH)4]-,因此1molAl(OH)3与碱反应时只能中和1molH+,表现为一元酸.
(1)据此请写出Al(OH)3的两性电离的方程式____________________;
(2)硼与铝是同族元素,试推测H3BO3是_____元酸,酸性是________(强或弱);并写出其电离的方程式_____________________________;
查看答案和解析>>
科目: 来源: 题型:
短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A和C处于同主族,B原子最外层电子数等于A原子次外层电子数,下列叙述不正确的是( )
A.原子半径A < B < C
B.A、B、C的固态氧化物分别是分子晶体、离子晶体和原子晶体
C.A单质的熔点高于C单质
D.A与B或C均可形成离子化合物
查看答案和解析>>
科目: 来源: 题型:
下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl=NH3↑+ HCl↑ B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目: 来源: 题型:
HgCl2 稀溶液可用作外科手术的消毒液。已知其熔点是227℃,不能导电,HgCl2 稀溶液有弱的导电能力。则下面关于HgCl2 叙述不正确的是( )
A.HgCl2 是电解质 B.HgCl2 是盐,属离子化合物
C.HgCl2 固体是分子晶体 D.HgCl2 是盐,属共价化合物
查看答案和解析>>
科目: 来源: 题型:
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
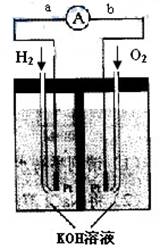 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。(3)电极表面镀铂粉的原因为
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2![]() 2LiH Ⅱ.LiH+H2O==LiOH+H2↑
2LiH Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 。
查看答案和解析>>
科目: 来源: 题型:
可逆反应N2 + 3H2![]() 2NH3,已达到平衡的标志是( )
2NH3,已达到平衡的标志是( )
A、 反应容器中,一定温度下,压强不随时间改变而改
B、 单位时间内有nmol N2生成,同时就有3nmolH2生成
C、单位时间内有nmol N2生成,同时就有nmol NH3生成
D、N2、H2、NH3的分子个数之比为1︰3︰2
查看答案和解析>>
科目: 来源: 题型:
随着人们生活质量的不断提高,废电池必须集中处理的问题越来越受到重视.其主要原因是( )
A.回收废电池外壳的金属材料
B.防止废电池中的汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗漏的电解液腐蚀其他物品 D.提炼稀有金属
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W有如右图所示的转化关系,已知焓变:
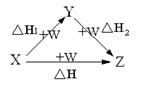 △H=△H1+△H2,则X、Y可能是
△H=△H1+△H2,则X、Y可能是
①C , CO ②AlCl3 , Al(OH)3 ③Fe , Fe(NO3)2 ④FeBr2 , FeBr3
A.①②③④ B.①② C.③④ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com