
科目: 来源: 题型:
世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。下列说法正确的是( )
A.二氧化氯是强氧化剂 B.二氧化氯是强还原剂
C.二氧化氯是离子化合物 D.二氧化氯中氯元素为-1价
查看答案和解析>>
科目: 来源: 题型:
下列反应中,不属于氧化还原反应的是( )?
A.3Cl2+6KOH![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
B.2NO2+2NaOH![]() NaNO3+NaNO2+H2O
NaNO3+NaNO2+H2O
C.SnCl4+2H2O![]() SnO2+4HCl
SnO2+4HCl
D.3CCl4+K2Cr2O7![]() 2CrO2Cl2+3COCl2+2KCl
2CrO2Cl2+3COCl2+2KCl
查看答案和解析>>
科目: 来源: 题型:
Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2![]() 2NaFeO4+2Na2O+2Na2SO4+O2↑对此反应下列说法中不正确的是( )
2NaFeO4+2Na2O+2Na2SO4+O2↑对此反应下列说法中不正确的是( )
A.Na2O2在反应中只作氧化剂?
B.O2是氧化产物?
C.Na2FeO4既是氧化产物,又是还原产物?
D.2 mol FeSO4发生反应时,共有10 mol电子转移?
查看答案和解析>>
科目: 来源: 题型:
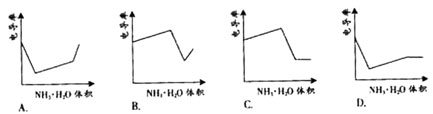
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率
变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶
液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表
示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
查看答案和解析>>
科目: 来源: 题型:
NA表示阿伏加德罗常数,下列说法中不正确的是( )
A.53g碳酸钠晶体中含0.5NA个CO32-离子
B.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
C.1molOH-放电被氧化时失去NA的电子
D.在2.8g晶体硅中含有0.2NA个Si-Si键
查看答案和解析>>
科目: 来源: 题型:
12.0g含2种化合物(由常见元素组成)的近白色固体溶于过量盐酸, 释放出2.94L气体(标准状态), 气体密度为同温度下空气密度的1.52倍; 剩余的不溶性残渣含氧53.2%,既不溶于酸又不溶于稀碱溶液。通过计算分别写出2种化学物质的化学式。
查看答案和解析>>
科目: 来源: 题型:
氧分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点。NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于_________(填编号)。
A、破坏臭氧层 B、高温下能使一些金属被氧化 C、造成酸雨 D、与人体血红蛋白结合
(2)在含Cu+(亚铜离子)的酶的活化中心,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式______________________________________
(3)在常温下,把NO气体压缩到100大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_________________.
(4)解释变化(3)中为什么最后气体总压力小于原压力的2/3?__________________________.
(5)NO成为“臭名昭著的明星分子”所包含的哲学原理是_____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com