
科目: 来源: 题型:
第题(分)酸是化学中重要的一类物质,人们对酸的认识是逐步加深的。
⑴ 1887年,阿仑尼乌斯提出了电离理论,在水溶液中能电离出H+的为酸,电离出OH??离子的为碱。比较水溶液中,下列阴离子的共扼酸的酸性大小_____________________(填序号)

⑵ 1905年,弗兰克提出了溶剂酸碱理论。该理论认为凡是在溶剂中产生该溶剂的特征阳离子的溶质叫酸,产生该溶剂的特征阴离子的溶质叫碱。试判断液NH3中加入Li3N后酸碱性变化情况,并结合方程式解释
⑶ 1923年布朗斯特提出了质子理论。认为凡是能够给出质子的物质都为酸,接受质子的物质为碱。有电子总数相同的三种微粒,它们既是质子酸又是质子碱,且分别为阴离子、中性分子和阳离子,它们是__________________________
⑷ 质子理论提出的同年,路易斯提出了电子理论,凡是接受电子对的为酸,给出电子对的为碱。NH3和NF3的均为路易斯碱, 碱性更强的是_____ __ ,
理由是____________ _______
⑸ 1966年第一个超强酸被偶然发现,通常由质子酸和路易斯酸混合。用SbF5与氟磺酸反应后,可得到一种超强酸H[SbF5(OSO2F)]。写出该超强酸在氟磺酸中的电离方程式。
查看答案和解析>>
科目: 来源: 题型:
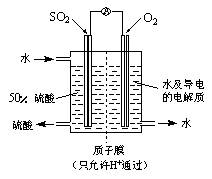
以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,碘水褪色,则该反应的离子方程式为 。
③E中盛有______________溶液。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙溶液
(3)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2的与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如右图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
通入SO2的电极为_________极,其电极反应式为:
。
电池的总反应式为:
。
查看答案和解析>>
科目: 来源: 题型:
从![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种物质中:
五种物质中:
(1)选取溶于水中会促进水电离,且溶液显碱性的物质,用离子方程式表示溶液其显碱性的原因:
;
(2)选取溶于水会抑制水电离,且溶液显酸性的物质,用化学用语表示其显酸性的原因:
;
(3)选取溶于水会促进水电离,且溶液显酸性的物质,用离子方程式表示溶液其显酸性的原因:
。
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,对可逆反应![]() 的下列叙述中,能说明反应已达到平衡的是( )
的下列叙述中,能说明反应已达到平衡的是( )
A.C生成的速率与C分解的速率相等
B.单位时间内消耗![]() 和同时生成3amolC
和同时生成3amolC
C.容器内的压强不再变化
D.混合气体的总物质的量不再变化
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A.向CuSO4溶液中投入一小块金属钠:![]()
B.向溴水中通入SO2气体:![]()
C.向Ca(ClO)2溶液中通入少量SO2气体:![]()
D.向KAl(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好完全沉淀:
![]()
查看答案和解析>>
科目: 来源: 题型:
在密闭容器中发生反应2SO2+O2![]() 2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
A.10mol和10% B.20mol和20%
C.20mol和40% D.30mol和80%
查看答案和解析>>
科目: 来源: 题型:
氮是地球上极为丰富的元素。![]()
![]()
![]()
![]()
![]()
![]()
![]()
( 1 ) Li3N 晶体中氮以 N-3存在,基态N-3的电子排布式为_。
( 2 ) ![]() 的键能为 942 kJ·mol-1 , N-N 单键的键能为 247kJ·mol-1,计算说明N2 中
的键能为 942 kJ·mol-1 , N-N 单键的键能为 247kJ·mol-1,计算说明N2 中
的 键比_键稳定(填“σ ”或“π ”)。
( 3 ) ( CH3 )3 NH+ 和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于 100 ℃ ,其挥发性一般比有机溶剂_(填“大”或“小” ) ,可用作_(填代号)。
a .助燃剂
b .“绿色”溶剂
c .复合材料
d .绝热材料
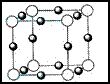 ( 4 ) x+中所有电子正好充满 K 、 L 、 M 三个电子层,它与 N3-形成的晶体结构如图所示。 X的元素符号是_,与同一个N3-相连的 x+今有_个。
( 4 ) x+中所有电子正好充满 K 、 L 、 M 三个电子层,它与 N3-形成的晶体结构如图所示。 X的元素符号是_,与同一个N3-相连的 x+今有_个。
查看答案和解析>>
科目: 来源: 题型:
我国发射载人航天飞船用火箭的起动炸药为氢化锂、氘化锂和氚化锂。它们 ( )
A.都是共价化合物 B.由同位素原子构成的同分异构体
C.具有较强还原性 D.所有结构微粒的半径全部都相同
查看答案和解析>>
科目: 来源: 题型:
工业废气的氮氧化合物是造成大气污染的主要来源之一,为保护环境,工业上常通入氨与之发生反应,NOX + NH3 →N2 + H2O 转化为无毒的N2,现有NO2、NO的混合气体3L,可用同温同压下3.5L NH3恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为( )
(A)3:1 (B)2:1 (C)1:1 (D)1:4
查看答案和解析>>
科目: 来源: 题型:
有关氨的性质的叙述中正确的是( )
A、氨能在空气中燃烧
B、氨水显碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3++H+=NH4+中,氨失去电子被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com