
科目: 来源: 题型:
【化学—物质结构与性质】
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题:
(1)周期表中比Ga质子数少2的基态原子价电子排布式为 。
(2)Fe元素位于周期表的 分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 ____和 _____(填化学式),CO的结构式为 。
(3)在CH4、CO及CH3OH中,碳原子采取sp3杂化的分子为 。
(4)根据VSEPR理论预测ED4- 离子的空间构型为______________型。B、C、D及E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:__________________________________(写2种) 。
(5)B与D形成的稳定化合物为___________分子(填“极性”“非极性”),其固态为 ________晶体。
查看答案和解析>>
科目: 来源: 题型:
现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100mL 2.0mol·L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入100mL 4.0 mol·L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且![]() pH=1。
pH=1。
则②产生气体的体积(标准状况)为( )
A.2.352L B.2.448L C.2.688L D.2.856L
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,22.4 L三氯甲烷中共价键数目为4NA
B.1mol Na2O2与足量的CO2和H2O(g)的混合物反应,转移的电子数为NA
C.足量MnO2与含4 mol HCl的浓盐酸反应生成的Cl2分子数为NA
D.1mol Cl2溶于水中转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入
 集气瓶后,烧杯中的水会进入集气瓶,该集气瓶中的气体可能是
集气瓶后,烧杯中的水会进入集气瓶,该集气瓶中的气体可能是
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②③ C.②④ D.③④
查看答案和解析>>
科目: 来源: 题型:
以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:

(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 ▲ 。
(2)下列有关说法正确的是 ▲ 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C![]() CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是
▲ 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫
酸铵反应的化学方程式 ▲ 。
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W四种短周期元素的原子序数依次增大,它们之间可以相互形成等电子数的A2B2型、AB型、A2型、A22—型等微粒。
1)若A22—型微粒的电子数为14时:
① 写出上述A2型微粒的结构式 _______________;
② 写出四种元素原子按5∶1∶1∶3形成的离子化合物与足量NaOH反应的离子方程式 ;
(2)若A2型微粒为最活泼的非金属单质时:
① 1mol A2B2型化合物分解转移电子的物质的量为 ;
② 写出一种具有相同电子数的![]() 有机物的化学式 ;
有机物的化学式 ;
③ 比较Z与W两种元素的氢化物的沸点 。
查看答案和解析>>
科目: 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾净水与胶体的性质有关
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速度
C.金属的冶炼:铝可用电解法,铁可用热还原法
D.化纤材料、高温结构陶瓷材料都属于新型有机合成材料
查看答案和解析>>
科目: 来源: 题型:
T℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图2所示:下列描述正确的是( )
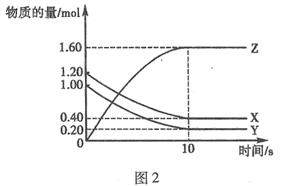
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积压缩为1 L,平衡向正反应方向移动
C.T℃时,该反应的化学方程式为:X(g)+Y(g)![]() 2Z(g),平衡常数K=40
2Z(g),平衡常数K=40
D.T℃时,若起始时X为0.71mol,Y为1.00 mol,则平衡时Y的转化率为60%
查看答案和解析>>
科目: 来源: 题型:
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.0.2mol/L NH4NO3和0.lmol/LNaOH溶液等体积混合后:c(NO3- )>c(Na+)>c(NH4+)>c(H+)>c(OH-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:![]()
c(CH3COOH)+2 c (H+) = c(CH3COO—)+2c(OH-)
D.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③
查看答案和解析>>
科目: 来源: 题型:
镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是 Cd+2OH-—2e-===Cd(OH)2,
2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-
 下列说法不正确的是
下列说法不正确的是
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断增大
D.电池充电时,电池的负极和电源的负极连接
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com