
科目: 来源: 题型:
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是 ( )
![]() A.加入有色布条,一会儿有色布条褪色,说明溶液中有C12存在
A.加入有色布条,一会儿有色布条褪色,说明溶液中有C12存在
![]() B.溶液呈黄绿色,且有刺激性气味,说明有C12分子存在
B.溶液呈黄绿色,且有刺激性气味,说明有C12分子存在
![]() C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有C1–存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有C1–存在
![]() D.加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在
查看答案和解析>>
科目: 来源: 题型:
自来水可用氯气消毒,某学生用这种自来水去配制下列物质溶液,会产生明显的药品变
质问题的是 ( )
A.NaNO3 B.FeCl2 C.Na2SO4 D.AlCl3
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
查看答案和解析>>
科目: 来源: 题型:
关于金属的腐蚀与防护,下列叙述正确的是
A.金属腐蚀就是金属失去电子被还原的过程
B.将需防腐的金属与外加直流电源的负极相连,正极与废铁相连
C.镀锌铁皮发生腐蚀时,正极的电极反应式为:Fe-2e → Fe2+
D.铁钉在潮湿空气中生锈,是因为直接发生反应:4Fe+3O2→2Fe2O3
查看答案和解析>>
科目: 来源: 题型:
某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:

![]()
其中①、②的反应方程式为:4NH3 + 5O2 ——→ 4NO+6H2O, 4NO+3O2+2H2O → 4HNO3
(1)若原料气的密度为1.25g/L(标准状况),则氨气与空气的体积比_________。
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为____________(保留2位小数,此时硝酸溶液的密度为1.38g/cm3)。
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为____________。
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化。求(写出计算过程):
(i)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg)。
(ii)合成硝酸铵的整个流程中,氨的总转化率。
查看答案和解析>>
科目: 来源: 题型:
根据下表信息,判断0.10mol/L的下列各溶液pH值最大的是
| A.CH3COONa B.Na2CO3 C.Na2S D.Na3PO4 |
|
查看答案和解析>>
科目: 来源: 题型:
如图所示,利用培养皿进行实验。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
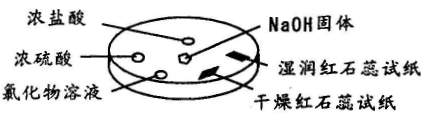 |
下表中对实验现象所做的解释不正确的是 ( )
| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与HCI反应产生了NH4CI固体 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3与水反应生成了NH3.H2O,电离出OH一使红色石蕊试纸变蓝 |
| D | 氯化物溶液变浑浊 | 可能是AICI3与NH3反应生成AI(OH)3 |
查看答案和解析>>
科目: 来源: 题型:
在下列给定条件的溶液中,一定能大量共存的离子组是 ( )
A.无色溶液:Ca2+、H+、Cl-、HSO-3
B.强酸性溶液中:Al3+、Fe2+、ClO-、SO2-4
C.c(OH-)=0.1mol·L-1的溶液:Na+、K+、SiO2-3、NO-3
D.含有0.1mol·L-1Ca2+的溶液:Na+、K+、Cl2-3、Cl-
查看答案和解析>>
科目: 来源: 题型:
 |
请结合下表数据,回答问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
|
| 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(1)写出下列离子方程式:
A→B ; B→C+D 。
(2)溶液A中加入NaClO的目的是 。
(3)在溶液B中加入CuO的作用是 。
(4)操作①应控制的pH范围是: ;操作②的目的是 。
(5)由Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用“稍多量盐酸”和“低温蒸干”的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com