
科目: 来源: 题型:
下列叙述正确的是( )
A.物质燃烧都是放热反应
B.化学反应总是伴随着能量的变化
C.化学反应中放出的热量一定等于吸收的热量
D.化学反应中放出的热才是反应热
查看答案和解析>>
科目: 来源: 题型:
对下列化学反应热现象,不正确的说法是( )
①放热的反应发生时不必加热 ②化学反应一定有能量变化 ③吸热反应需要加热后才能发生 ④化学反应焓变的数值与参加反应物质的多少有关
A.①② B.②③ C.①③ D.②④
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生
查看答案和解析>>
科目: 来源: 题型:
已知盐酸或硫酸和烧碱的稀溶液反应的热化学方程式为:
H+(aq)+OH-(aq)=H2O(l);△H=-Q1 kJ·mol-1。已知,HF(aq)+KOH(aq)=KF(aq)+H2O(l);△H=-Q2 kJ·mol-1。则Q1与Q2关系正确的是( )
A.Q1=Q2 B.Q2<Q1 C.Q2>Q1 D.无法比较
查看答案和解析>>
科目: 来源: 题型:
200mL 0.1mol·L-1 Ba(OH)2溶液和0.2mol·L-1 300mL盐酸混合,放出的热量是( )
A.57.3 kJ B.1.9813 kJ C.2.292 kJ D.1.718 kJ
查看答案和解析>>
科目: 来源: 题型:
1.5g火箭燃料二甲基肼(CH3-NH-NH-CH3)完全燃烧,放出50 kJ热量,则二甲基肼的燃烧热为( )
A.1000kJ/mol C.2000kJ/mol
B.1500kJ/mol D.3000kJ/mol
查看答案和解析>>
科目: 来源: 题型:
已知拆开1mol H-H键需436kJ热量,拆开1molN-H键需391kJ的热量,根据化学方程式N2+3H2![]() 2NH3;Q=-92.4kJ,则拆开1molN≡N键需要的热量为( )
2NH3;Q=-92.4kJ,则拆开1molN≡N键需要的热量为( )
A.431kJ B.946 kJ C.649 kJ D.869 kJ
查看答案和解析>>
科目: 来源: 题型:
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定 的相似性;Mg和Na的化学性质也具有一定的相似性。
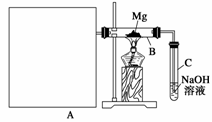
Ⅰ.用如上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。
(1)选择制取SO2的合适试剂______________(填序号)。
①10%的H2SO4溶液 ②80%的H2SO4溶液
③Na2SO3固体 ④CaSO4固体
(2)写出装置B中发生的主要反应的化学方程式:
________________________________________________________________________
______________________。装置C中NaOH溶液的作用是_______________。
(3)请在图中画出制备SO2的发生装置并注明主要仪器的名称,固定仪器省略不画。
(4)你认为该装置的不足之处是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到 以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件 下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均 不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着:“……选用合适的物质在适宜的条件下充分反应,再用足量 稀硫酸溶解固体产物;然后过滤、洗涤、干燥,最后称量……在用稀硫酸溶解固体产物 时,发现有爆鸣声和火花,其产率也只有预期值的63%左右。”
(5)该小组“实验室制Si”的化学方程式是
________________________________________________________________________。
(6)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
已知A~I有如图所示转换关系:
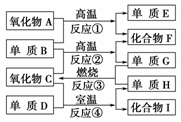
已知:①单质E可作为半导体材料;
②化合物F是不能生成盐的氧化物;
③化合物Ⅰ能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
(1)化合物F是________。
(2)化合物Ⅰ是____________。
(3)反应③的化学方程式是
________________________________________________________________________。
(4)反应④的化学方程式是
________________________________________________________________________。
(5)写出Ⅰ的水溶液与A反应的方程式:
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅 的主要方法,生产过程示意图如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
① 写出由纯SiHCl3制备高纯硅的化学反应方程式
________________________________________________________________________
________________________________________________________________________。
② 整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式
________________________________________________________________________;
H2还原SiHCl3过程中若混入O2,可能引起的后果是
________________________________________________________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液, 振荡。写出实验现象并给予解释:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com