
科目: 来源: 题型:
下列叙述中正确的是
A.1 mol H20的质量是18 g·mol-1
B.硫酸根离子的摩尔质量是96 g
C.C02的摩尔质量是44 g·mol-1
D.HCl的相对分子质量是36.5 mol-1
查看答案和解析>>
科目: 来源: 题型:
下列配制的溶液浓度偏高的是
A.配制盐酸溶液用量筒量取盐酸时俯视刻度线
B.配制盐酸溶液定容时,仰视容量瓶刻度线
C.称量4 g NaOH 配制0.1 mol·L-1 NaOH溶液1000 mL时,砝码错放左盘
D.NaOH溶解后未经冷却即注入容量瓶至刻度线
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式,书写正确的
A.碳酸钙和盐酸反应 CO32-+2H+=H20+CO2↑
B,向氢氧化钡溶液中加硫酸溶液 Ba2++ SO42-=BaSO4
C.向硝酸银溶液中加盐酸 Ag++C1-=AgCl↓
D.向稀盐酸溶液中加铁粉 3Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目: 来源: 题型:
设No表示阿伏加德罗常数数值,下列叙述中正确的是
A. 常温常压下,48 g O3含有的氧原子数为3 No
B.1.8 g的NH4+ 离子中含有的电子数为0.1 No
C.常温常压下,11.2 L氧气所含的原子数为No
D.2.4 g金属镁变为镁离子时失去的电子数为0.1 No
查看答案和解析>>
科目: 来源: 题型:
某厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
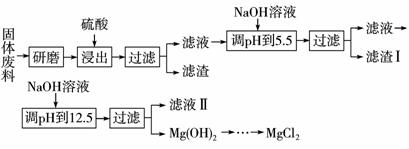
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 12.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_______________(要求写出两条)
(2)滤渣Ⅰ的主要成分有____________。
(3)从滤液Ⅱ中可回收利用的主要物质有____________。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
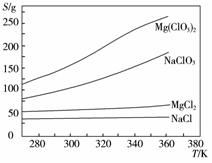
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:_________________。
②按①中条件进行制备实验。在冷却降温析出Mg
(ClO3)2过程中,常伴有NaCl析出,原因是:
_______________。除去产品中该杂质的方法是:____________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00 mL溶液;
③量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
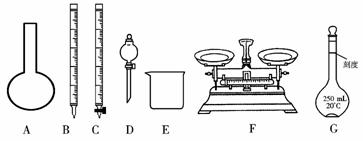
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和____________(填字母)。
(2)步骤②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为____________ mL,量取该体积的浓H2SO4用到量筒规格是____________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
□Fe2++□ClO2□□=□Fe3++□Cl-+□H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成____________(填“偏大”“偏小”或“不影响”),等物质的量的ClO2与Cl2的氧化效率之比为____________。
(4)第⑥步的操作中,将沉淀物转移到____________(填仪器名称)中加热,冷却至室温,称量其质量为m1 g,再次加热并冷却至室温称量其质量为m2 g,若m1与m2差值较大,接下来的操作应当是____________。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会____________(填“偏大”“偏小”或“不影响”);若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为____________(列出算式,不需化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com