
科目: 来源: 题型:
现有四种系列同族元素形成的物质,它们的沸点(℃,P=1.01×105Pa)如下表所示,
| ① | He -268.8 | Ne -249.5 | Ar (x) | Kr -151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (a) 58.7 | I2 184.0 |
| ③ | HF (y) | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O (z) | H2S -60.2 | (b) -42.0 | H2Te -1.8 |
试根据上表回答下列问题
(1)a为____________色液体;b的分子式为_______________。
(2)写出②系列中物质主要化学性质的递变规律(任写一种)_______ _____
____________________;能够说明该递变规律的化学事实是_________________________
(任举一例,用离子方程式表示)。
3)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是___________________________________________________________________。
(4)上表中,______和______两种物质的沸点较同系列其它物质反常,反常的主要原因是_____________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:
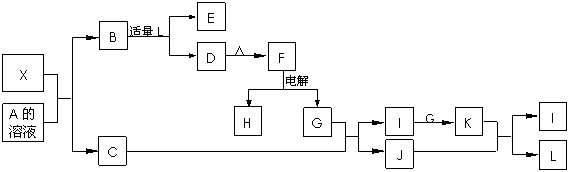
(1)写出X的化学式:__________,X属于__________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:_____________________________________。
写出K与J反应的化学方程式:_____________________________________。
(3)若B中加入足量的L,则不能生成D物质,请用离子方程式表示其原因:
。
(4)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
![]() + 2N2
+ 2N2 ![]() 4X + SiC + 3C。
4X + SiC + 3C。
查看答案和解析>>
科目: 来源: 题型:
科学家从化肥厂生产的![]() 中检出组成为
中检出组成为![]() 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以![]() 和
和![]() 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收![]() ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是______________(填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
(2)![]() ______________(填“能”或“不能”)和草木灰混合施用:
______________(填“能”或“不能”)和草木灰混合施用:
(3)已知白磷、![]() 的空间构型均为四面体,
的空间构型均为四面体,![]() 的结构式为
的结构式为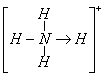 (
(![]() 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为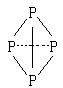
请画出![]() 的结构式____________________________________;
的结构式____________________________________;
(4)已知液氨中存在着平衡![]() 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的![]() 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
(5)含有一定量![]() 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时:![]()
加碱时:![]()
由于![]() 和
和![]() 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中![]() 与
与![]() 基本保持不变;
基本保持不变;
含有一定量![]() 和
和![]() 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时_____________________________________________;
加碱时_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
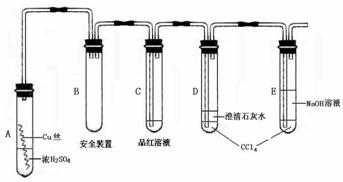
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
 |
根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:___________。设计实验验证你的猜想________________。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____。(写化学式)
查看答案和解析>>
科目: 来源: 题型:
下列有关化学实验的操作或说法中,正确的是(填字母序号) 。
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体。
B.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可
C.中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低。
D.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次。
E.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
F.向2mLl0%NaOH溶液中滴入2%CuSO4溶液的4—6滴,振荡后加入乙醛溶液0.5
mL,加热至沸腾,则有红色沉淀出现。
查看答案和解析>>
科目: 来源: 题型:
过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等,钨的最高价为+6价。现有钨酸钠晶体(Na2WO4·2 H2O)0.990g加水溶解后,再加入一定量的锌和稀H2SO4,反应生成一种蓝色化合物(可看作含+5价、+6价混合价态的钨的氧化物)且无H2产生。现用0.044mol/L KMnO4酸性溶液滴定这种蓝色化合物恰好将其氧化为一种黄色化合物,KMnO4中的+7价锰被还原成Mn2+,共耗去KMnO4酸性溶液8.20mL(已知在酸性条件下氧化性;KMnO4>+6价的W的化合物)。上述蓝色化合物是
A.W10O21 B.W8O22 C.W10O27 D.W5O14
查看答案和解析>>
科目: 来源: 题型:
2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如2分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR',反应式可表示为:2RCH=CHR'—→ RCH=CHR + R'CH=CHR'
现有结构简式为CH2=CHCH3和CH2=C(CH3)2的两种烯烃,发生上述的“烯烃复分解反应”,能生成多种新的烯烃。下列说法正确的是
A.生成的新烯烃共有4种
B.生成的各种新烯烃中,每个烯烃分子与HCl加成后,都只能生成一种产物
C.生成的所有新烯烃分子中,每个分子中的碳原子均共面
D.生成的所有新烯烃分子中,只有两种新烯烃分子中的碳原子共面
查看答案和解析>>
科目: 来源: 题型:
下列推断符合实际的是
A.第n周期的最后一种金属元素处在第n—1族(1<n<7,n为正整数)
B.m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物
C.第n周期有n种主族金属元素(1<n<7,n为正整数)
D.m—n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸
查看答案和解析>>
科目: 来源: 题型:
下列各组物质中,不能按![]() (“→”表示一步完成)关系相互转化的是
(“→”表示一步完成)关系相互转化的是
| A | B | C | D | |
| a | Fe | CH2=CH2 | Al(OH)3 | HNO3 |
| b | FeCl3 | CH3CH2Br | NaAlO2 | NO |
| c | FeCl2 | CH3CH2OH | Al2O3 | NO2 |
查看答案和解析>>
科目: 来源: 题型:
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(![]() )中形成的,电池总反应方程式为:
)中形成的,电池总反应方程式为:
8Li+3SOCl2=6LiCl+Li2SO3+2S,下列叙述中正确的是
A.若电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被氧化为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com