
科目: 来源: 题型:
氯气溶于水达到平衡后,下列叙述正确的是 ( )
A.再通入少量氯气,![]() 减小
减小
B.通入少量SO2,溶液的漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.该反应的离子方程式为Cl2+H2O=H++Cl-+HClO
查看答案和解析>>
科目: 来源: 题型:
某温度时,把1molN2O4气体通入体积为10L的真空容器,立即出现红棕色,反应进行4s时,NO2的浓度为0.04mol/L,再经过一段时间后,反应达平衡,这时容器内压强为开始时的1.8倍.则下列说法正确的是:
A、前4s中以N2O4的浓度变化表示的平均反应速率为0.01 mol/L·s
B、在4s时容器内的压强为开始时的1.2倍
C、在平衡时容器内含N2O4 0.4 mol
D、在平衡时容器内含NO2 1.2 mol
查看答案和解析>>
科目: 来源: 题型:
汽车的启动电源常用铅蓄电池。放电时的电池反应如下:
PbO2 + Pb + 2H2SO4 ![]() 2PbSO4↓+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4↓+ 2H2O,根据此反应判断下列叙述中正确的是( )
A.PbO2是电池的负极
B.负极的电极反应式为:Pb + SO![]() - 2e—
- 2e— ![]() PbSO4↓
PbSO4↓
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
查看答案和解析>>
科目: 来源: 题型:
已知:4NH3 (g)+5 O2 (g)![]() 4NO (g)+6 H2O (g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO (g)+6 H2O (g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
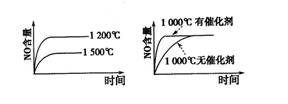
A B C D
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,下列叙述不能作为可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率是B的生成速率的2/3倍 ②单位时间生成a mol A,同时生成3a mo1B ③A、B、C的浓度不再变化 ④混合气体的总压强不再变化
⑤混合气体的物质的量不再变化 ⑥单位时间消耗 a mol A,同时生成3amolB
⑦A、B、C 的分子数目比为1∶3∶2
A.②⑦ B.⑥④ C.①③ D.⑤⑥
查看答案和解析>>
科目: 来源: 题型:
体积不变的密闭容器中进行如下反应: X2(g) + 3Y2(g) ![]() 2Z(g),X2、Y2、Z起始浓度分别为0.2mol.L—1 、 0.6mol.L—1 、0.4mol.L—1 ,当平衡时,下列数据肯定不对的是
2Z(g),X2、Y2、Z起始浓度分别为0.2mol.L—1 、 0.6mol.L—1 、0.4mol.L—1 ,当平衡时,下列数据肯定不对的是
A. X2为0.4mol.L—1,Y2为1.2mol.L—1 B. Y2为1.0mol.L—1
C. X2为0.3mol.L—1,Z为0.2mol.L—1 D. Z为0.6mol.L—1
查看答案和解析>>
科目: 来源: 题型:
对于平衡体系2SO2(g)+O2(g) ![]() 2SO3(g) △H<0。下列结论中正确的是( )
2SO3(g) △H<0。下列结论中正确的是( )
A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍
B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1
C.若从平衡体系中分离出SO2,则有利于提高SO2的转化率和加快正反应速率
D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2
查看答案和解析>>
科目: 来源: 题型:
下图装置中,小试管内为红墨水,具支试管内盛有ph=4的雨水和生铁片。观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合适的是 ( )
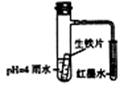 A.生铁片中的碳是原电池的负极,发生还原反应
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳极反应式为:O2+2H2O+4e-====4OH-
D.具支试管中溶液pH逐渐减小
查看答案和解析>>
科目: 来源: 题型:
下列有关化学反应原理的应用叙述正确的是 ( )
A.用明矾净水是因为Al2+水解生成的Al(OH)3胶粒具有很强的吸附性
B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率
C.往铁钉镀铜时,用铜做阴极
D.电解饱和食盐水制烧碱,NaOH在阳极区域产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com