
科目: 来源: 题型:
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b两个电极均由多孔的碳块组成,通人的氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电。
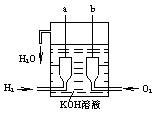
(1)该燃料电池发生的总的化学方程式是: ,其电极分别为a是 极,b是 极(填正或负),
其电极反应分别是: a极: b极:
(2)如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合
K2、K3通直流电,则: 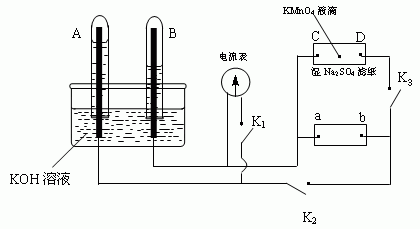
①标出电源的正、负极,a为______极,b为_____极。
②在湿的Na2SO4滤纸条中心的KMnO4液滴,有什么现象______________。
③写出电极反应式:A中_________________,B中__________________。
④若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针是否移动(填是或否)_________。
⑤若电流表指针不移动说明理由,若指针移动也说明理由_______________。
查看答案和解析>>
科目: 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目: 来源: 题型:
下图表示373K时,反应A(g) ![]() 2B(g)在前110s内的反应进程(将该反应看作匀速进行的)
2B(g)在前110s内的反应进程(将该反应看作匀速进行的)
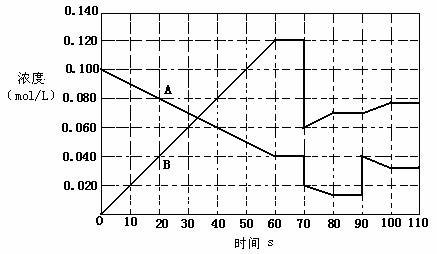
T(K) |
K |
温度 | 273K | 323K | 373K |
平衡常数 | 0.005 | 0.022 | 0.36 |
(1)此反应的平衡常数的表达式K=_____________。
(2)A(g) ![]() 2B(g)在不同温度下的K值见上表,则该反应的逆反应为__________(填“吸热”或“放热”)反应。
2B(g)在不同温度下的K值见上表,则该反应的逆反应为__________(填“吸热”或“放热”)反应。
(3)升高温度,B的转化率__________(填“增大”、“减小”或“不变”,下同),B的反应速率_______________。
(4)373K时,在一密闭容器中,将A气体放入进行反应,据图判断,80-90s内反应向哪个方向移动___________(填“向左”、“向右”、“不移动”),90s时曲线变化的原因是(用文字表达)_________________________,反应进行到70s时,改变的条件可能是(填编号)_____________________
A、加入催化剂 B、扩大容器体积 C、升高温度 D、增大A的浓度
查看答案和解析>>
科目: 来源: 题型:
(1)甲烷是一重要的清洁能源、请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式: 。
 (2)电解原理在化学工业中有广泛的应用。图中a为电解液,X
(2)电解原理在化学工业中有广泛的应用。图中a为电解液,X
和Y是两块电极板,则:
①若X和Y分别为铁和石墨,a为饱和食盐水,
则电解时X电极反应式为 。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解
过程中生成的白色固体露置在空气中,可观察到的现象是
。
(3)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。电解完毕后,某兴趣小组欲对电解溶中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如下图。

①结合右图分析,相同温度下Kap[Cu(OH)2]、Kap[Ni(OH)2]、Kap[Fe(OH)2]由大到小的顺序为 。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+、Fe2+和Ni2+沉淀的先后顺序依次为 (填写离子符号)。
查看答案和解析>>
科目: 来源: 题型:
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) ![]() kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) ![]() kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的![]() 。
。
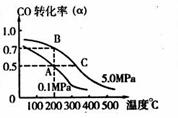
(2)在10L密闭容器中充有10 molCO 与20molH2,
在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(![]() )
)
与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,
则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I
I![]() (aq) △H=Q,某I2、KI混合溶液中,I
(aq) △H=Q,某I2、KI混合溶液中,I![]() 的物质的量浓度c(I
的物质的量浓度c(I![]() )与温度T的关系如图所示(曲线上任何一点表示平衡状态)。下列说法正确的是 ( )
)与温度T的关系如图所示(曲线上任何一点表示平衡状态)。下列说法正确的是 ( )
![]()
A.反应:I2(aq)+I-(aq) ![]() I
I![]() (aq) △H=Q,的Q>0
(aq) △H=Q,的Q>0
B.若温度为T1、T2反应的平衡常数分别为K1,K2,则![]()
C.若反应进行到状态D,一定有![]()
D.状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目: 来源: 题型:
有关甲、乙、丙、丁四个图示的叙述正确的是 ( )
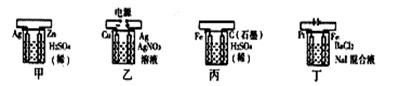
A.甲中负极反应式为:2H++2e-=H2↑
B.乙中阳极反应式为:Ag++e-=Ag
C.丙中H+向石墨棒方向移动
D.丁中电解开始时阴极产生黄绿色气体
查看答案和解析>>
科目: 来源: 题型:
在下列各组溶液中的离子一定能大量共存的是 ( )
A.加入KSCN溶液显红色的溶液:K+、NH![]() 、Cl-、I-
、Cl-、I-
B.常温下,pH=1的溶液:Fe3+、Al3+、Br-、SO![]()
C.滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO![]()
D.含![]() 的溶液:K+、Ca2+、NO
的溶液:K+、Ca2+、NO![]() 、OH-
、OH-
查看答案和解析>>
科目: 来源: 题型:
用CH4催化还原NO2可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2(g)△H=-1160kJ·mol-1
下列说法不正确的是 ( )
A.由反应①可推知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(L)△H>-574kJ·mol-1
B.等物质的量的CH4参加反应时,放出的热量为17.34kJ
C.若用0.2moLCH?4还原NO2至N2,放出的热量为17.34kJ
D.若用0.02moLCH4还原NO2至N2,整个过程中转移的电子总数为0.16mol
查看答案和解析>>
科目: 来源: 题型:
t°C时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下该反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
A.升高温度,平衡常数K一定增大
B.增大压强,W(g)质量分数增加
C.该反应的化学反应方程式为X+2Y ![]() 2Z+2W
2Z+2W
D.增大X(g)浓度,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com