
科目: 来源: 题型:
下列各组离子在指定条件下一定不能大量共存的是 ( )
A.在加入铝粉能产生氢气的溶液中:NH4+、 Fe2+、SO42-、NO3-
B.c (H+)=0.lmol·L-1的溶液中:Cu2+、A13+、SO42-、NO3-
C.能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2-
D.在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42-
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.标准状况下,11.2 L SO3所含的原子数为2NA
B.标准状况下,22.4L氧气和乙炔混合物所含的分子数为NA
C.0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA
D.46g NO2和N2O4的混合物所含的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
我国三峡工程所提供的清洁、价廉、可再生的水电,相当于每年燃烧500万吨原煤的火力发电厂生产的电能,因此三峡工程有助于控制 ( )
A.温室效应 B.氮的氧化物排放
C.白色污染 D.对臭氧层的破坏
查看答案和解析>>
科目: 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
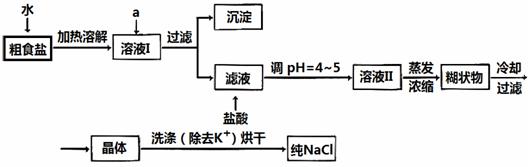
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 (只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。
 (2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、玻璃棒外还有
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、玻璃棒外还有
(填仪器名称)。
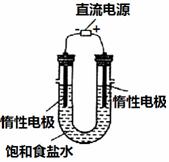
(3) 电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因 。
查看答案和解析>>
科目: 来源: 题型:
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、
NO3- 、SO42-、Cl-、I-、HCO3-,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴石蕊 | 溶液变红色 |
| ②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,后在空气中又变成红棕色 |
| ③取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ⑤取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是
。
查看答案和解析>>
科目: 来源: 题型:
位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式 , ,
, 。
(2)C与D形成D的最低价化合物的电子式: 。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:______ 。
查看答案和解析>>
科目: 来源: 题型:
5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。
查看答案和解析>>
科目: 来源: 题型:
根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有 种,其中之一为日常生活中常见的金属,其单质与强酸、强碱都能反应,写出该金属单质与氢氧化钠溶液反应的离子方程式,
;
(2)属于稀有气体的是 (填元素符号,下同);
(3)形成化合物种类最多的元素是 ;
(4)第三周期中,原子半径最大的是(稀有气体除外) ;
(5)推测Si、N最简单氢化物的稳定性 大于 (填化学式)。
⑹第ⅥA元素中沸点最低的元素的氢化物的电子式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com