
科目: 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);![]() mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L![]() min)
min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目: 来源: 题型:
高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2 浓度减小。下列说法正确的是
。恒容时,温度升高,H2 浓度减小。下列说法正确的是
A.该反应的焓变为正值 B.恒沮恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应化学方程式为CO+H2![]()
CO2+H2
查看答案和解析>>
科目: 来源: 题型:
关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。其化学机理为:① HUr + H2O![]() Ur - + H3O+ ②Ur-(aq)+Na+(aq)
Ur - + H3O+ ②Ur-(aq)+Na+(aq) ![]() Na Ur(s)
Na Ur(s)
尿酸 尿酸根离子
下列对反应②叙述中正确的是( )
A.正反应的△H>0 B.正反应的△H<0
C.升高温度平衡正向移动 D.降低温度平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,反应CO+NO2![]() CO2+NO达到平衡后,降低温度,混和气体的颜色变浅。下列判断正确的是( )
CO2+NO达到平衡后,降低温度,混和气体的颜色变浅。下列判断正确的是( )
A.正反应为吸热反应 B.正反应为放热反应 C.CO的平衡转化率降低 D.各物质的浓度不变
查看答案和解析>>
科目: 来源: 题型:
在相同的温度下,已知反应:① N2(g)+O2(g)![]() 2NO(g)的平衡常K=3.84×10-31
2NO(g)的平衡常K=3.84×10-31
② 2SO2(g)+O2(g)![]() 2SO3(g)的平衡常K=3.10×1026(mol•L-1)-1则在该温度下,两个化学反应的反应程度之间的关系为( )
2SO3(g)的平衡常K=3.10×1026(mol•L-1)-1则在该温度下,两个化学反应的反应程度之间的关系为( )
A、 ①> ② B、 ①< ② C、 ①= ② D、不能确定
查看答案和解析>>
科目: 来源: 题型:
![]() 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应___________
X电极上发生的电极反应____________________________; 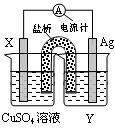
(3)外电路中的电子是从_______电极流向________电极。
查看答案和解析>>
科目: 来源: 题型:
右图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色---红色,碱色---黄色)
回答下列问题:
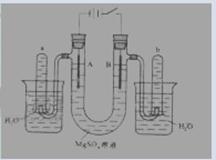
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄; ② B溶液由红变黄 ③ A管溶液不变色 ④B管溶液不变色
(2)写出A管中发生反应的反应式:
(3)写出B管中发生反应的反应式:
(4)检验a管中气体的方法是
(5)检验b管中气体的方法是
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是
查看答案和解析>>
科目: 来源: 题型:
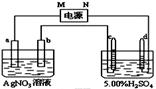 右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是________,其质量为___________。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶___∶____∶____。
(4)AgNO3溶液的浓度(填增大、减小或不变,下同)_______,AgNO3溶液的酸性____,H2SO4溶液的酸性______。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com