
科目: 来源: 题型:
某学生用NaHCO3和KHCO3组成的某化合物进行试验,测得如下数据(盐酸的物质的量浓度相等):
| 实验编号 | ① | ② | ③ |
| 盐酸体积 | 50mL盐酸 | 50mL盐酸 | 50mL盐酸 |
| m(混合物) | 9.2g | 16.56 g | 27.6 g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
根据表中数据试计算:
(1)盐酸的物质的量浓度。
(2)混合物中NaHCO3的质量分数。
查看答案和解析>>
科目: 来源: 题型:阅读理解
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。已知:常温下,CO能使一些化合物中的金属离子还原![]()
例如:PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。ks*5*u
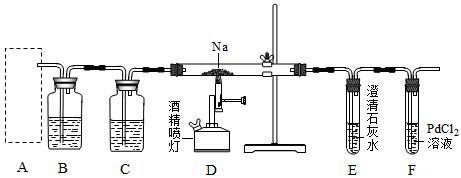
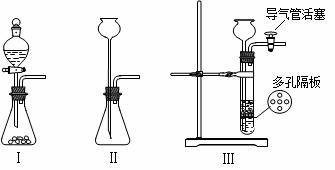
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是___________________________,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是______(填写 “Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B、C中各盛放的试剂分别为_____________、_____________。
(2)装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________。待装置______(填写字母)中出现_____________________现象时,再点燃酒精喷灯,这步操作的目的是________________________________。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是_________________________________________________________。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式(需注明正确的反应条件)是_______________________________________________。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐还是酸式盐 理由:___________________________________________________________________。ks*5*u
查看答案和解析>>
科目: 来源: 题型:
某化学实验小组将适量浓硝酸分多次滴加入到足量铜粉、足量稀硫酸的混合物中,加热使之反应完全,通过过滤、蒸发、结晶来制得硫酸铜晶体(装置如图1、2所示)。

(1)写出圆底烧瓶中开始阶段发生反应的化学方程式:
。
(2)把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是________________ 。
(3)图2是图1的改进装置,其优点有___________________、_____________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
仔细阅读下图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。请按要求回答:ks*5*u
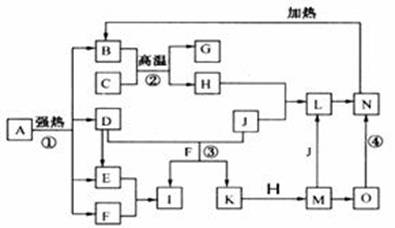
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A强热分解的化学反应方程式为_________________________________________。
(2)写出反应②在工业生产上的一种用途:_____________________________________。
(3)反应③的离子方程式为___________________________________________;
反应④的化学方程式为___________________________________________。
(4)常以C或H制成容器盛装和运输I的浓溶液,其原理是__________________________
___________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。ks*5*u
|
|
|
|

则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
![]()
①写出步骤①的化学方程式 。ks*5*u
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和
HCl(沸点—84.7℃),提纯SiHCl3的主要化学操作的名称是 。
③粉末状硅能猛烈地与强碱溶液作用,试写出该反应的离子方程式 。
(2)磁性材料。这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护。最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的正极反应式 。ks*5*u
(3)纳米材料。胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,三氯化铁可起到净水的作用,用离子方程式表示其原理 ,三氯化铁溶液可以加速伤口止血,请简述原因 。
(4)高分子材料。可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂
[AlFe(OH)nCl6—n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为 。
一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH2=CH—CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下
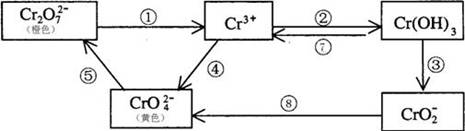
回答下列问题:
(1)上述反应中需用氧化剂的是 (填编号)。
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应和溶液中进行的反应的离子方程式:
阳极_____ _____ 阴极_______ ____
溶液中________________ ___________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式 。
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是 。
查看答案和解析>>
科目: 来源: 题型:
根据实验目的判断下列实验操作或装置正确的是
| 选项 | 目的 | 装置或操作 | 选项 | 目的 | 装置或操作 |
| A | 精炼铝 |
| C | 在铁制品上镀铜 |
|
| B | 配制稀硫酸溶液 |
| D | 净化、精制淀粉胶体 |
|
查看答案和解析>>
科目: 来源: 题型:
某金属M的氯化物MCl2的相对分子质量为a,溶解度为Sg,现取质量为Wg的MCl2在一定温度下完全溶解配成VmL饱和溶液,若溶液的密度为dg/cm3,溶液的物质的量浓度为cmol/L,溶液中溶质的质量分数为ω%,则下列关系式中不正确的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为2∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶10 B.1∶8 C.1∶6 D.1∶5![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com