
科目: 来源: 题型:
)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
 (1)以上操作步骤中有一步有错误,请指出编号 ,该错误操作会导致测定结果
(1)以上操作步骤中有一步有错误,请指出编号 ,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 中。
(从下图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是: (填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟之内不再改变。
 (5)以下是实验数据记录表
(5)以下是实验数据记录表
通过计算可得,该盐酸浓度为: mol·L-1(计算结果保留4位小数)。
查看答案和解析>>
科目: 来源: 题型:
在氯化铵溶液中,下列关系正确的是
A.c(Clˉ)>c(NH4+)>c(H+)>c(OHˉ) B.c(NH4+)>c(Clˉ)>c(H+)>c(OHˉ)
C.c(NH4+)+c(H+)=c(Clˉ) +c(OHˉ) D.c(NH4+)=c(Clˉ)>c(OHˉ)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
常温下,下列各组离子一定能大量共存的是
A.Na+、K+、Cl-、CH3COO- B.Ba2+、K+、SO42-、CO32-
C.Al3+、K+、CO32-、Cl- D. Na+、Fe3+、Cl-、SO42-
查看答案和解析>>
科目: 来源: 题型:
下列热化学方程式正确的是(注:![]() 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g) △H=—1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+ HCl(aq)= NaCl(aq)+ H2O(l) △H=—57.3kJ/mol(中和热)
C.S(s)+ O2(g)= SO2(g) △H= —269.8kJ/mol(反应热)
D.2NO2 = O2 + 2NO △H= +116.2kJ/mol(反应热)
查看答案和解析>>
科目: 来源: 题型:
下列电离方程式或离子方程式书写正确的是
![]() A.H2CO3在水溶液中的电离方程式:H2CO3
A.H2CO3在水溶液中的电离方程式:H2CO3![]() H++HCO3ˉ
H++HCO3ˉ
B.醋酸与氢氧化钠反应的离子方程式:H+ + OHˉ![]() H2O
H2O
C.NaHCO3在水溶液中的电离方程式:NaHCO3 = Na+ + H+ + CO32ˉ
D.CuSO4在水溶液中水解的离子方程式:Cu2++2H2O ![]() Cu (OH)2+2H+
Cu (OH)2+2H+
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A.铁与稀H2SO4反应时,加入少量CuSO4溶液,可使反应速率加快
B.构成原电池的正极和负极必须是两种不同的金属
C.在铁上镀铜时,金属铜作阴极
D.用惰性电极电解饱和氯化钠溶液,溶液的pH不变
查看答案和解析>>
科目: 来源: 题型:
能使H2O ![]() H++ OHˉ电离平衡向正反应方向移动,而且所得溶液显酸性的是
H++ OHˉ电离平衡向正反应方向移动,而且所得溶液显酸性的是
A.将水加热到99℃,使水![]() 的pH=6.1 B.在水中滴入稀H2SO4
的pH=6.1 B.在水中滴入稀H2SO4
C.在水中加入Na2CO3固体 D.在水中加入氯化铝固体
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,体积不变的密闭容器中可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.气体的密度不再变化 B.单位时间内生成n molA,同时生成3n molB
C.A、B、C的浓度不再变化 D.A、B、C的浓度之比为1:3:2
查看答案和解析>>
科目: 来源: 题型:
在298K、100kPa时,已知:2H2O(g)= O2(g)+ 2H2(g) △H1
Cl2(g)+ H2(g)=2HCl(g) △H2
2Cl2(g)+ 2H2O(g)=4HCl(g)+ O2(g) △H3
则△H3与△H1和△H2之间的关系正确的是
A .△H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1-△H2
查看答案和解析>>
科目: 来源: 题型:
在2X(g) ![]() 2Y(g) + Z(g) △H<0 的可逆反应体系中,在不同温度(T1>T2)下,生成物Z在反应混合物中的百分含量与反应时间(t)的关系有以下图示,其中正确的是
2Y(g) + Z(g) △H<0 的可逆反应体系中,在不同温度(T1>T2)下,生成物Z在反应混合物中的百分含量与反应时间(t)的关系有以下图示,其中正确的是
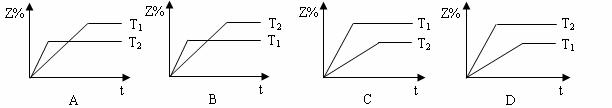
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com