
科目: 来源: 题型:
下图是元素周期表的一部分,其中所列字母分别代表某一元素
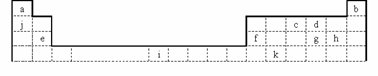
(1)写出元素k基态原子的核外电子排布式________________________。
(2)e、f单质及ef形成的合金的硬度由大到小的顺序为__________(用具体名称回答)。
(3)用来组成酸、碱、盐三类物质至少需要的元素有_________(用表中列出元素符号填写)。
|
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第
族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势
画出了两条折线:折线a和折线b,你认为正确的是 。
查看答案和解析>>
科目: 来源: 题型:
惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。
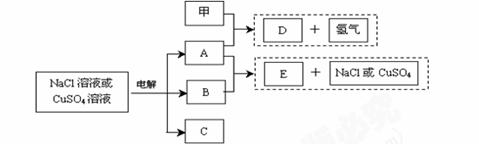
回答下列问题:
(1)若电解的是NaCl溶液:
①甲与A反应的化学方程式是 。
②A与B反应的离子方程式是 。
③若电解100mL0.1 mol·L-1NaCl溶液,阴、阳两极各产生112mL气体(标准状
况),则所得溶液的pH为 (忽略反应前后溶液的体积变化及气体溶于
水的影响)。
(2)若电解的是CuSO4溶液:
①E的化学式是 ;电解时阳极的电极反应式是 。
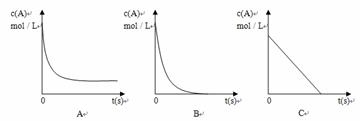
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确
是 。
查看答案和解析>>
科目: 来源: 题型:
常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为 。已知Ksp(BaA)= 1.8×10-10,向该混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(3)若溶液M由下列三种情况:①0.01mol·L-1的H2A溶液②0.01mol·L-1的NaHA溶液③0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为_______ ;pH由大到小的顺序为_________________ 。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为___________(填“大于、等于、小于”或“均有可能”)。
查看答案和解析>>
科目: 来源: 题型:
CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配置CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,原因是 ,最后,他向烧杯中加入了一定量的 溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。
①图一是根据反应Zn + CuSO4 = Cu + ZnSO4 设计成的锌铜原电池。
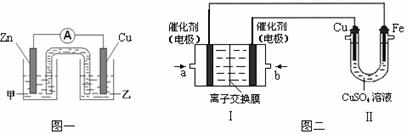
电解质溶液甲是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式
是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学
想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处
电极上发生的电极反应式是 。
(3)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其 有效成分为难溶的碱式硫酸铜[xCuSO4 ·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
查看答案和解析>>
科目: 来源: 题型:
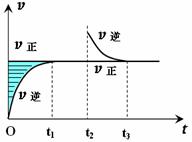 某恒温密闭容器发生可逆反应Z(?)+W(?)
某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是 ( )
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是 ( )
A.Z和W在该条件下一定不为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体
的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
科目: 来源: 题型:
NA代表阿伏加德罗常数的数值,下列说法正确的是 ( )
A.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
B.常温下,42 g丁烯和环丙烷的混合气体中含有的σ键数目为3NA
C.常温下,1mol SiC中含有Si-C键的数目为4 NA
D.常温常压下,17g甲基(—14CH3)所含的中子数为9NA
查看答案和解析>>
科目: 来源: 题型:
下列解释实际应用的原理表达式中,不正确的是 ( )
A.用排饱和食盐水法收集Cl2:Cl2 + H2O ![]() H+ + Cl-+ HClO
H+ + Cl-+ HClO
B.用热的纯碱溶液清洗油污:CO32- + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
C.用Na2CO3溶液处理水垢中的CaSO4:CaSO4 + CO32-= CaCO3 + SO42-
D.用TiCl4制备TiO2:TiCl4 +(x+2)H2O(过量)![]() TiO2·x H2O↓+ 4HCl
TiO2·x H2O↓+ 4HCl
查看答案和解析>>
科目: 来源: 题型:
设NA为阿伏加德罗常数的值,下列判断正确的是 ( )
A.含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2
B.标准状况下,22.4L己烷中共价键数为19NA
C.0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA
D.氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子
查看答案和解析>>
科目: 来源: 题型:
25℃时,水中存在电离平衡:H2O ![]() H++OH- ΔH>0。下列叙述正确的是( )
H++OH- ΔH>0。下列叙述正确的是( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com