
科目: 来源: 题型:
恒温时,在某密闭容器中通入2molA(g)和1molB(g),发生如下反应:
2A(g)+B(g)![]() 2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
2C(g),压强一定时,测得在平衡时C的体积分数为0.4。
(1)与上述平衡保持同温、同压,另取4molA(g)和2molB(g)达平衡,则C的体积分数为多少?平衡时,气体的总物质的量是多少?
(2)在另一密闭容器中,通入n(A) molA(g)和n(B)molB(g),若保持平衡时C的体积分数仍为0.4,则恒有an(B)<n(A)<bn(B),问a、b各为多少?
查看答案和解析>>
科目: 来源: 题型:
已知几种难溶电解质的溶度积如下表所示:
几种难溶电解质的Ksp(25℃) | |
沉淀溶解平衡 | Ksp |
AgBr(s) | 5,0×10-13mol2·L-2 |
AgI(s) | 8.3×10-17mol2·L-2 |
FeS(s) | 6.3×10-18mol2·L-2 |
ZnS(s) | 1.6×10-24mol2·L-2 |
CuS(s) | 1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则c(I-) (填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+) (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
查看答案和解析>>
科目: 来源: 题型:阅读理解
材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ。
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.60 | 0.20 | 0.80 |
14 | 0.60 | 0.20 | 0.80 |
(1)写出该反应的热化学反应方程式: 。
(2)该温度下反应的平衡常数K= 。
(3)若该反应的逆反应速率与时间的关系如上右图所示,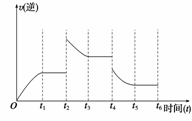 则:
则:
① t2~t3时平衡向 (填“正”或“逆”)反应方向移动。
② t4时被改变的外界条件是 (选择一个正确选项)
A.升温 B. 降温 C.降压 D.移去部分反应物 E.加入负催化剂
材料2.另有实验,利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
实验 编号 | 温度/K | 盐酸浓度 /mol·L-1 | 醋酸浓度/mol·L-1 | 实验目的 |
① | 298 | 0.20 | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 | |
② | 308 | 0.20 | ||
③ | 298 | 0.40 | ||
④ | 0.20 | 0.20 | ||
⑤ |
 (4)请完成上工作表(填写实验④⑤的空格)。
(4)请完成上工作表(填写实验④⑤的空格)。
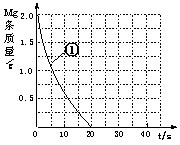
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁
条剩余质量与时间关系图如右图。
Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率
v(HCl),尚缺少的数据是 。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温
度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图
中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与
时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁
均能完全溶解)。
查看答案和解析>>
科目: 来源: 题型:
在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
(1)填写下表中的空格(结果保留一位小数)。
| ① V(NaOH)(mL) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 |
| ②溶液的pH | 1.0 | 2.3 | 3.3 | 4.3 | 7 | 9.7 | 10.7 |
(2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意
图,并指出该滴定曲线的特点。
(3)一般中和滴定操作要求误差≤0.1%,其关键之一是选择合适的指示剂来确定终点。你认为能否用甲基橙作上述反应的指示剂,说明理由。
(4)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度________(填“大”、“小”或“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42 -为指示剂,这是因为AgCl比Ag2CrO4更______溶的缘故。
查看答案和解析>>
科目: 来源: 题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H
(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- ![]() H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) ![]() H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) ![]() H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 ![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中
c(NH4+)=c(Cl-)。则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目: 来源: 题型:
ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是________________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
查看答案和解析>>
科目: 来源: 题型:
25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1∶100混合,反应后所得溶液pH=7。若x=![]() y,则x值为 ( )
y,则x值为 ( )
A.2 B.3 C.4 D.5
查看答案和解析>>
科目: 来源: 题型:
在指定环境下,下列各组离子可以大量共存的是 ( )
A.在无色透明溶液中:Al3+、Na+、HCO3-、Cl-
B.在能使甲基橙呈红色的溶液中:Mg2+、NH4+、Fe2+、I-
C.加入铝粉放出氢气的溶液: K+、Ca2+、NO3-、SO42-
D.在水电离产生的H+的浓度为1×10-13mol・L-1的溶液:Cu2+、Na+、NO2-、SO42-
查看答案和解析>>
科目: 来源: 题型:
反应N2O4(g)![]() 2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目: 来源: 题型:
在一容积恒定密闭容器中,等物质的量的A和B发生如下反应:
A(g)+2B(g) ![]() 2C(g),一段时间后反应达到平衡,若同温度下所得混合气体压强是原来的4/5,则这时A的转化率是 ( )
2C(g),一段时间后反应达到平衡,若同温度下所得混合气体压强是原来的4/5,则这时A的转化率是 ( )
A.40% B.50% C.60% D.70%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com