
科目: 来源: 题型:
下图表示反应![]()
![]()
![]() ,
,![]() ,在某温度时
,在某温度时![]() 的浓度随时间变化的曲线:
的浓度随时间变化的曲线:
 下列有关该反应的描述正确的是
下列有关该反应的描述正确的是
A.第6![]() 后,反应就终止了
后,反应就终止了
B.![]() 的平衡转化率为85%
的平衡转化率为85%
C.若升高温度,![]() 的平衡转化率将大于85%
的平衡转化率将大于85%
D.若降低温度,v正 > v逆
查看答案和解析>>
科目: 来源: 题型:
锗元素的原子序数为32,据此可推测
A.在周期表中位于第四周期、第VIA族
B.单质可能做半导体材料
C.金属性比同主族的铅强
D.最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目: 来源: 题型:
以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
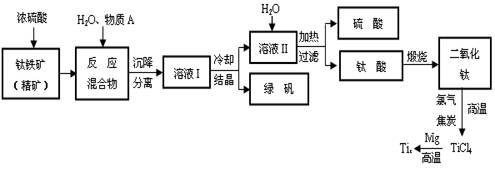
回答下列问题:
⑴ 钛铁矿和浓硫酸反应属于 (选填“氧化还原反应”或“非氧化还原反应”)。
⑵上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 ,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是 。
⑶反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是 。
⑷由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g) ΔH1 = -72 kJ·mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g) ΔH2 =+38.8kJ·mol-1
C(s)+CO2(g)=2CO(g)??ΔH3 =+282.8kJ·mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是 。
②反应C(s)+O2(g)=CO2 (g)的ΔH= 。
查看答案和解析>>
科目: 来源: 题型:
一定温度下,溴化银在水中的沉淀溶解平衡曲线如下图。下列说法正确的是
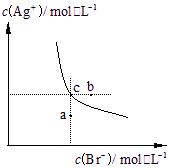
A.向溴化银的浊液中加入溴化钠溶液,
溴化银的Ksp减小
B.图中a点对应的是不饱和溶液
C.向c点的溶液中加入0.1![]()
![]() ,则
,则![]() 减小
减小
D.升高温度可以实现c点到b点的转化
查看答案和解析>>
科目: 来源: 题型:
把一块镁铝合金投入到1 mol·L-1 盐酸中,待合金完全溶解后,再往溶液里加入1 mol·L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如右图所示。下列说法中错误的是
A.盐酸的体积为80 mL
B.a的取值范围为0 < a<50
C.n (Mg2+) < 0.025 mol
D.当a值为30时,b值为0.01
查看答案和解析>>
科目: 来源: 题型:
一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是 ( )
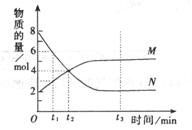
A.t1时,N的浓度是M浓度的2倍
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.反应的化学方程式为:2M![]() N
N
查看答案和解析>>
科目: 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是 (填字母),其中化合价为+3价的是 (填字母);若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
查看答案和解析>>
科目: 来源: 题型:
四种短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示,Y、Z质子数之和为21,下列说法中不正确的是 ( )
|