
科目: 来源: 题型:
物质的量相同的戊烷,苯和苯酚完全燃烧需要氧气的物质的量依次是x,y,Z,则x,y,Z的关系正确的是 ( )
A.x>y>z B.y>z>x C.z>y>x D.y>x>z
查看答案和解析>>
科目: 来源: 题型:
浓度为0.1mol/L的8种溶液:①HNO3 ②H2SO4③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl溶液pH值由小到大的顺序是(填写编号)____________。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是 ( )
A.电离平衡常数受溶液浓度的影响
B.电离平衡常数可以表示弱电解质的相对强弱
C.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
D.H2CO3的电离常数表达式:![]()
查看答案和解析>>
科目: 来源: 题型:
二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂,常温下二氧化氯为黄绿色或橘黄色气体,易溶于水,易与碱液反应,其性质非常不稳定,温度过高、二氧化氯的水溶液质量分数高于30%等均有可能引起爆炸。某研究小组设计下图所示实验装置制备ClO2。

现称取12.25gKClO3和9g草酸(H2C2O4)放入烧瓶中,然后再加入足量的稀硫酸,水浴加热。
回答下列问题:
(1)已知反应后的产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为 。
(2)在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60℃~
80℃之间。这样操作的目的是 ,
图示装置中缺少的一种必须的玻璃仪器是 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放 (填序号)。
a. 50mL 60℃的温水 b. 50mL冰水 c. 50mL饱和食盐水 d. 50mL NaOH溶液
(4)本实验所制得的二氧化氯水溶液质量分数约为 。(小数点后保留两位)
(5)二氧化氯可迅速氧化硫化物,以除去有机硫产生的臭味,改善水产养殖水体的水质。取适量二氧化氯溶液加入到硫化氢溶液中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。硫化氢溶液与二氧化氯发生反应的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
![]() (1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);△H
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);△H
如图表示某次合成实验过程中甲醇的体积分数 φ(CH3OH)与反应温度的关系曲线,
则该反应的△H 0(填“>、< 或 = ”)
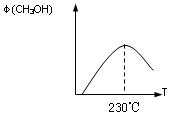
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、< 或 = ”)
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如图所示的装置:
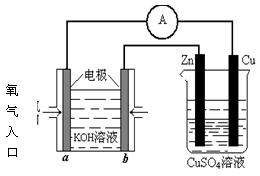
则该装置中Cu极为 极;写出b极的电极反应式
当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。
(5)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。
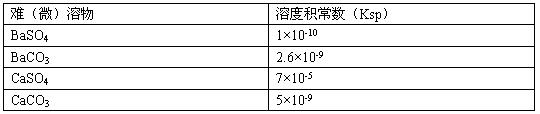
具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ mol·L-1
查看答案和解析>>
科目: 来源: 题型:
主族元素W、X、Y、Z位于同一周期,原子序数依次增大,W、X是金属元素.Y、Z是非金属元素。W、X的最高价氧化物对应的水化物可以相互反应,W与Y可形成化合物W2Y,Y的最外层电子数是核外电子层数的2倍。下列说法正确的是
A.Y的气态氧化物比z的气态氢化物稳定
B.W的最高价氧化物对应的水化物是已知最强的碱
C.Y单质和氧气、氢气都能发生化合反应,且产物都具有还原性
D.W、X、Y、Z四种元素的原子半径由小到大的顺序是:W<X<Y<Z
查看答案和解析>>
科目: 来源: 题型:
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至1200C左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(气体体积均折算到标准状况的体积):

(1)实验过程中有关反应的离子方程式为: 。
(2)计算用1.85克样品进行同样实验时,生成氨气在标准状况的体积为 。
(3)计算确定该混合物中(NH4)2SO4和NH4HSO4的物质的量之比 。
(4)欲计算该NaOH溶液的物质的量浓度应选择第 组数据,由此求得NaOH溶液的物质的量浓度为 。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ、已知一个碳原子上连有两个羟基时,易发生下列转化。请根据下图回答问题:

Ⅱ、已知F具有如下特点:①能跟FeCl3溶液发生显色反应;②1mol F最多可消耗2mol NaOH;③F只有一个环且苯环上的一氯代物只有两种。

(1)已知B的相对分子质量为178,其燃烧产物中![]() ,则B的分子式是 ,所有F可能的结构简式为: 。
,则B的分子式是 ,所有F可能的结构简式为: 。
(2)写出①的反应方程式: ;
写出③的反应方程式: 。
(3)若F的同分异构体中,属于酯类的芳香族化合物有 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com