
科目: 来源: 题型:
在4℃时向100ml水中溶解了22.4LHCl气体(标准状态下测得)后形成的溶液。下列说法中正确的是( )
A、该溶液物质的量浓度为10mol/L
B、所得的溶液的体积为22.5L
C、根据题干数据,该溶液物质的量浓度无法求得
D、该溶液中溶质的质量分数因溶液的密度未知而无法求得
查看答案和解析>>
科目: 来源: 题型:
已知2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
2SO3(g)(正反应放热)。若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是
A.若降低温度,可以加快反应速率 B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2能完全转化为SO3
D.达到平衡时,SO2和SO3的浓度一定相等
查看答案和解析>>
科目: 来源: 题型:
类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是
A.不能用电解AlCl3来制取Al,也不能用电解MgCl2来制取镁
B.金刚石的硬度大,则C60的硬度也大
C.CO2与SiO2化学式相似,则CO2与SiO2的物理性质也相似
D. Na、K在周期表中属于同一主族,化学性质相似,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
查看答案和解析>>
科目: 来源: 题型:
在下列实验中,不能达到目的的是
A. 用NaHCO3鉴别低级醇和低级羧酸
B. 用石墨做电极电解Mg(NO3)2、Cu(NO3)2 的混合溶液,确定铜和镁的金属活动性强弱
C. 将氯化铁固体溶解在少量浓盐酸中,然后稀释得到氯化铁溶液
D. 淀粉作指示剂,用已知浓度的碘水滴定未知浓度的FeCl2溶液测定其物质的量浓度
查看答案和解析>>
科目: 来源: 题型:
已知热化学方程式:SO2(g)+ 1/2O2(g) ![]() SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
A.196.64kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z三种元素原子具有相同的电子层数,x的最高价氧化物对应水化物呈碱性,Y的最高价氧化物对应水化物呈酸性,而z的最高价氧化物对应水化物呈两性,则它们的原子序数逐渐增加的顺序是
A.X、Y、Z B.X、Z、Y C.Z、Y、X D.Y、Z、X
查看答案和解析>>
科目: 来源: 题型:
2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如2分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR'。则分子式为C4H8的烯烃中,任取两种发生“复分解反应”,生成新烯烃种类最多的一种组合中,其新烯烃的种类为
A.5种 B.4种 C.3 种 D.2种
查看答案和解析>>
科目: 来源: 题型:
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;V的氢化物电子式为___________;Z元素在周期表中的位置是_____________。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体
③ 分子晶体 ④ 金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明 。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)____________________。
查看答案和解析>>
科目: 来源: 题型:
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
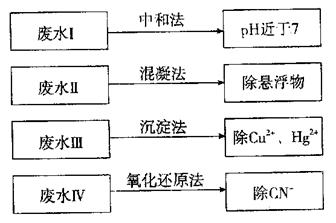
(1)①废水I若采用CO2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2++ =====CH3Hg++H+
我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含 Hg2+3×10-17mo1,是否达到了排放标准 (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式为 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr20,溶液的仪器是 。
②Ⅱ中,碎瓷片的作用是 。
③III中,发生的反应为:Cr2O2-7+6Fe2++14 H+==2Cr3++6Fe3+7H2O
由此可知,该水样的化学需氧量COD= (用含c、V1、V2的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com