
科目: 来源: 题型:
下图是CH2=CH—CH=CH2合成D(OHC—CH=CH—CHO)的流程。
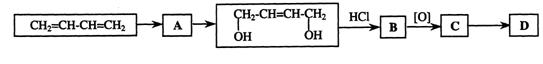
回答下列问题:
(1)若A为溴代物写出其结构简式 。
(2)写出B![]() C反应的化学方程式 。
C反应的化学方程式 。
(3)写出C![]() D的反应类型 。
D的反应类型 。
(4)已知CH2=CH—CH=CH2+CH2=CH2![]()
![]() ,请写出CH2=CH—CH=CH2两分子加成后的产物 。
,请写出CH2=CH—CH=CH2两分子加成后的产物 。
查看答案和解析>>
科目: 来源: 题型:
影响化反应速率的因素很多,某校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响化学反应速率的因素。
甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②___________________ | 反应速率Fe>Mg,Cu反应 | 金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________;
(2)甲同学的实验目的是_________________________;要得出正确的实验结论,还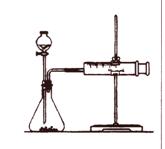 需要控制实验的条件是_____________________________;
需要控制实验的条件是_____________________________;
乙同学为了更精确地研究浓度对反应速率的影响,
利用右图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是_________________________;
(4)乙同学完成该实验应选用的实验药品是_________________________。
查看答案和解析>>
科目: 来源: 题型:
在2升的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A.1.6 mol B.1.6 mol C.2.4 mol D.2.8mol
查看答案和解析>>
科目: 来源: 题型:
下图表示某些常见物质之间的转化关系(反应条件已略去),其中A、D为气态非金属单质 ,B、C为金属单质,B为红色,E、F、G、H为化合物,G为无色液体,甲、乙、丙、丁、戊为溶液,丙为强酸的稀溶液。①、②均为工业冶炼B的反应。
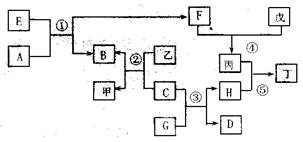
请回答下列问题:
(1)F由同族两种元素组成,可用于食物增白,也是大气污染物之一,污染来源主要是 ,它在大气中可形成丙,反应的化学方程式为 。反应④也可以生成丙,反应的离子方程式为 ;
(2)由反应①制得的金属B含杂质,工业上用 方法将B提纯至99.95%以上。利用热还原制得的金属C,也含杂质,在潮湿的中性环境中,C较易发生腐蚀,化学方程式为 ,C经反应③的处理,表面生成黑色晶体H后,可减缓蚀;
(3)检验溶液丁中金属离子的方法是 ;
(4)E可由单质直接化合得到,则E的化学式为 ,反应①的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
[化学与技术]硫酸在日常生产生活中应用非常广泛。请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是 。
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N2 82%);
|
转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
利用表中数据分析。在实际生产中选择的适宜生产条件是:温度_______ ℃,压强 ___________MPa。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? _______(填“是”或“否”),是否可以增大该反应所放出的热量? (填“是” 或“否”)。
(4)为提高SO3吸收率,实际生产中用 吸收SO3。
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是______(填写序号)。
A.保护环境。防止空气污染 B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率 D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用 ________(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
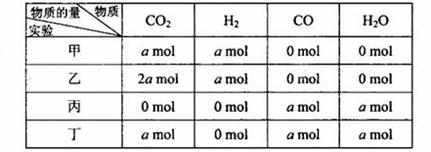
上述四种情况达到平衡后,n(CO)的大小顺序是
A.丁>乙>丙=甲 B.乙>丁>甲>丙
C.乙=丁>丙=甲 D.丁>丙>乙>甲
查看答案和解析>>
科目: 来源: 题型:
已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色固体,易溶于二硫化碳。
(1)请写出元素符号: B___________、D___________。
(2)画出E的阴离子的结构示意图 ______________________。
(3)A的单质和C的单质在一定条件下反应生成化合物X,用电子式表示化合物X的形成过程:____________________________ _______。向X的水溶液中滴入酚酞溶液,会观察到什么现象:_________________________。
查看答案和解析>>
科目: 来源: 题型:
X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X、Y形成的化合物的化学式可表示为:
A.XY2 B.XY C.XY3 D.X2Y3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com