
科目: 来源: 题型:
以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
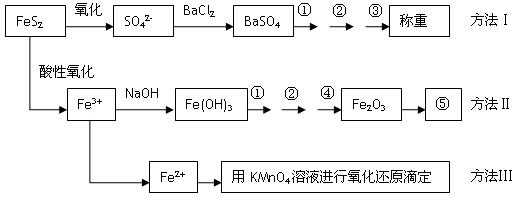
请回答下列问题:
(1)流程图中操作①、②、③分别指的是:①___________、②__________、③________。
操作④、⑤用到的主要仪器是:④_____________、⑤_____________(每空填1-2个仪器)。
(2)判断溶液中SO42-离子已沉淀完全的方法是
。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,(A)用带有刻度的烧杯配制成100 mL试样溶液。(B)用量筒量取25.00 mL待测溶液,(C)并置于锥形瓶中。(D)用蒸馏水洗涤滴定管后装入KMnO4标准溶液,用该标准溶液滴定待测试样,(E)当溶液变成淡紫红色时,停止滴定,如30秒内不褪色,(F)读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量。
请指出该实验过程中错误操作步骤的编号:____________________。
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是________________________________________________ _____
。
(5)称取矿石试样1.60 g, 按方法Ⅰ分析,称得BaSO4的质量为4.66 g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是________。
查看答案和解析>>
科目: 来源: 题型:
根据图中包含的信息分析,下列叙述正确的是( )
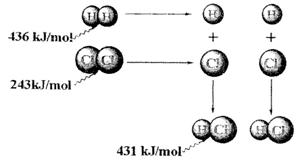
A.氢气与氯气反应生成1mol氯化氢气体,反应的![]() =+248kJ/mol
=+248kJ/mol
B.436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量
C.氢气与氯气反应生成2mol氯化氢气体,反应的![]() =-183kJ/mol
=-183kJ/mol
D.该反应的热化学方程式是H2(g)+Cl2(g)==2HCl(g) ![]() =+183kJ/mol
=+183kJ/mol
查看答案和解析>>
科目: 来源: 题型:阅读理解
化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:
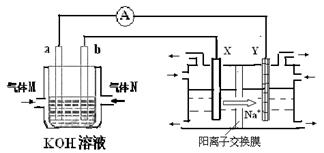
(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g)![]() 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2 、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2 、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:

根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)
查看答案和解析>>
科目: 来源: 题型:
以下说法中正确的是:
A. △H<0的反应均能自发进行。
B. △S为负值的反应均不能自发进行。
C. 冰在室温下自动熔化成水,是熵增加的结果。
D. 碳酸氢铵固体加热分解是一个熵减小的过程。
查看答案和解析>>
科目: 来源: 题型:
1943年,侯德榜先生研究成功了联合制碱法,该方法不仅提高了食盐的利用率,还在得到纯碱的同时获得了重要的副产品氯化铵。下列关于Na2CO3溶液和NH4Cl溶液的说法正确的是 ( )
A.适当升温,两溶液的pH均增大
B.常温下pH=10的碳酸钠溶液与pH=4的氯化铵溶液中水的电离程度相同
C.0.1 mol/L Na2CO3溶液中![]()
D.0.1 mol/L NH4Cl溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
在二氧化碳的水溶液中存在着如下平衡:
C02(g) ![]() C02(aq) C02(aq)+H20
C02(aq) C02(aq)+H20![]() H2C03(aq)
H2C03(aq)
H2C03(aq) ![]() H+ (aq)+HCO3-(aq) HCO3-(aq)
H+ (aq)+HCO3-(aq) HCO3-(aq) ![]() H+(aq)+CO32-(aq)
H+(aq)+CO32-(aq)
下列有关说法正确的是( )
A.水中溶解的二氧化碳的浓度,夏天时比冬天时高
B.如果海水略呈碱性,海水中二氧化碳的浓度比纯水高
C.气压升高,水中c(HCO3-)增大
D.常温下,二氧化碳的水溶液中,由水电离出的c(H+)与c(OH-)的乘积等于1×lO-14
查看答案和解析>>
科目: 来源: 题型:
通常情况下,下列各选项中的两个量,前者一定大于后者的是
A.物质的量浓度相等的醋酸钠溶液和次氯酸钠溶液的pH
B.25℃的纯水和100℃的纯水中的c(H+)
C.物质的量浓度相等的硫酸氢铵溶液和氯化铵溶液中c(NH4+)
D.读取量筒中一定体积的液体时,仰视的读数和俯视的读数
查看答案和解析>>
科目: 来源: 题型:
已知:A、E是非金属固体单质,气体F能使品红溶液褪色,C分子中有22个电子。A—H有如下转化关系(有部分产物略去):
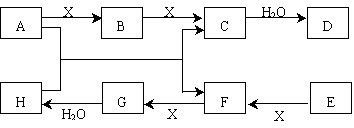
请回答:
(1)C的化学式 该分子的电子式为: 。
该分子为: (填极性、非极性)分子。
F的化学式 。
(2)X的一种同素异形体与人类生存环境密切相关,该物质的化学式是 ,
X转化成它的方程式是: 。
(3)单质A与单质E化合生成的物质的化学式为 。
(4)写出A+H→C+F的化学反应方程式并标出电子转移的方向和数目:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com