
科目: 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列系正确的是
A、离子的还原性:Y2->Z- B、质子数:c>b
C、氢化物的稳定性:H2Y>HZ D、原子半径:X<W
查看答案和解析>>
科目: 来源: 题型:
25℃、101kPa下,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol能自发进行的原因是)
A.是吸热反应 B.是放热反应
C.是熵减小的反应 D.熵增效应大于热效应
查看答案和解析>>
科目: 来源: 题型:
把少量CO2分别通入到浓度相同的:①Ba(NO3)2溶液;②Ba(OH)2溶液;③溶有氨的BaCl2溶液中。能观察到白色沉淀的溶液是
A.只有② B.②和③ C.①和② D.③
查看答案和解析>>
科目: 来源: 题型:
X元素原子的质量数为m,核内中子数为n,则wgx+含有电子的物质的量是( )
A.(m-n)w/m mol B.(m-n-1)w/m mol C.(m+n)w/m mol D.(m-n+1)w/m mol
查看答案和解析>>
科目: 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下, NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
查看答案和解析>>
科目: 来源: 题型:
由氧化铜和氧化铁的混合物a g,加入2 mol·L-1的硫酸溶液50 mL,恰好完全溶解,若将a g的该混合物在过量的CO气流中加热充分反应,冷却后剩余固体的质量为( )
A、1.6a g B、(a-1.6) g C、(a-3.2) g D、无法计算
查看答案和解析>>
科目: 来源: 题型:
工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得工业盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是 ( )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极反应式这Cl2+2e- == 2Cl―
查看答案和解析>>
科目: 来源: 题型:
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-l Ba(OH)2溶液。随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如下图所示。下列说法正确的是 ( )
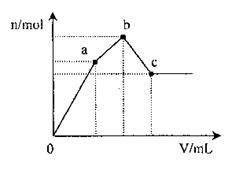
A.a点的沉淀总物质的量为0.025mol
B.oa段发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓
C.ab段发生反应的离子方程式是: NH4++SO42-+Ba2++OH-=NH3 ·H2O+BaSO4↓
D.反应至c点,加入Ba(OH)2溶液的总体积为250 mL
查看答案和解析>>
科目: 来源: 题型:
某体系中存在如下反应:
① H2S+4H2O-8e → SO42-+10H+ ② 2IO3-+12 H++10e → I2+6H2O
(1)反应①中H2S做_______剂,反应②属于_______ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成 g 碘。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:
_______________________________________________________________________
(4)由上述反应可推知 。
a.氧化性:K2SO4 > KIO3 b.酸性:H2S> H2SO4
c.还原性: H2S > I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目: 来源: 题型:阅读理解
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质。过程如下:
提出猜想
① 在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 常况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO有氧化性,能被H2、CO等还原,也能被氮的气态氢化物还原吗?
实验探究
⑴ 解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行相关实验。k*s*5*u
⑵ 解决问题②的实验步骤和现象如下:取一定量的Cu(OH)2固体,加热至80 ℃~100 ℃时,得到黑色固体粉末,继续加热到1000 ℃以上,黑色粉末全部变成红色粉末氧化亚铜。向氧化亚铜中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。根据以上现象写出氧化亚铜和稀硫酸反应的离子方程式 。
⑶为解决问题③,设计了如下的实验装置(夹持装置未画出):
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体Y。现有氮的某种气态氢化物X气体0. 0l mol,缓缓通过红热的氧化铜玻璃管完全反应后,测得C装置增重0. 36g并收集到单质气体Y0.28g。
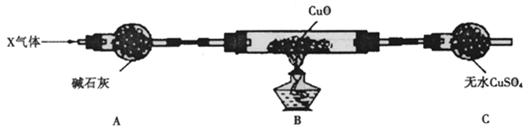
X气体的摩尔质量 ,B中发生反应的化学方程式为 。
(4)请猜测用上述装置测量时有可能产生误差的原因
. (答1条即可)
实验结论k*s*5*u
⑴Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是
. 。
⑵ 根据实验方案⑵,得出的+1价Cu和+2价Cu稳定性大小的结论是:
.
⑶ CuO能够被氮的气态氢化物还原。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com