
科目: 来源: 题型:
已知在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是( )
A. 加入纯Cu将Fe2+还原为Fe
B. 向溶液中通入H2S使Fe2+沉淀
C. 向溶液中通入Cl2,再通入NH3,调节pH值为4~5
D. 向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4~5
查看答案和解析>>
科目: 来源: 题型:
某高聚物的结构式为下列分析正确的是 ( )
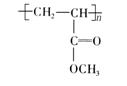
A.它是缩聚反应的产物
B.其单体是CH2![]() CH2和HCOOCH3
CH2和HCOOCH3
C.它燃烧后产生CO2和H2O的物质的量之比为1∶1
D.其单体为CH2 ![]() CHCOOCH3
CHCOOCH3
查看答案和解析>>
科目: 来源: 题型:
2009年10月1日为庆祝祖国60华诞的联欢晚会在北京天安门广场举行,当晚8时许,璀璨的焰花从天安门广场四面八方腾空而起、交相辉映,把整个联欢晚会现场烘托得热烈喜庆。其中开篇"60"字样的高空焰火,象征民族大团结的56个“笑脸”、60支和平鸽让数万观众眼前为之一亮。这写都与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )

A.焰色反应均应透过蓝色钴玻璃观察
B.NaC1与Na2CO3灼烧时火焰颜色相同
C.非金属单质燃烧时火焰均为无色
D.所有金属及其化合物灼烧时火焰均有颜色
查看答案和解析>>
科目: 来源: 题型:
常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1L溶液,
(1)该溶液中存在的___________个平衡体系;
(2)溶液中共有___________种不同的粒子;
(3)这些粒子中浓度为0.01 mol·L-1的是____________ ,浓度为0.002 mol·L-1的是______________;
(4)物质的量之和为0.01 mol 的两种粒子是____________________;
(5)_________和__________两种粒子数量之和比OH-多0.008 mol。
查看答案和解析>>
科目: 来源: 题型:
化学与生产、生活、社会密切相关。下列有关说法中不正确的是
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰。
D.氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料。
B.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物。
D.食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质。
查看答案和解析>>
科目: 来源: 题型:
用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,下列说法正确的是
A.阴极反应式为:Cu2++2e—====Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.阴极先是Fe3+放电,后Cu2+放电
D.阴极上不可能析出铜
查看答案和解析>>
科目: 来源: 题型:
有机物A只含有C.H、O三种元素,常用作有机合成的中间体。16. 8g该有机物经燃烧生成44.0g CO2和14.4g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1。
(1)A的分子式是____。A的结构简式是 。
(2)下列物质中,一定条件能与A发生反应的是——。
A.H2 B.Na C.KMnO4 D.Br2
(3)有机物B是A的同分异构体,1mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。B中含氧官能团的名称是 ,B的结构简式是____ 。
(4)B可以通过下列变化得到四元环状化合物F
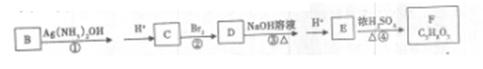
请写出反应③化学方程式 ;
上述转化关系中①、②、④的反应类型是:____ , , 。
查看答案和解析>>
科目: 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为,下列叙述不正确的是
![]()
A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO![]() + 4H2O
+ 4H2O
C.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
标准状况下,往100mL 0.1mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是( )
A.0.224L B.0.336L C.0.448L D.0.672L
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E为短周期的五种元素,它们原子序数依次递增,B是构成有机物的主要元素;A与C可形成10电子化合物W,它可使紫色石蕊试液变蓝;D元素的原子最外层电子数是其次外层电子数3倍;E是同周期元素中原子半径最大的元素;A、B、C、D可形成化合物X,在X晶体中阳离子与阴离子个数比为1∶1;A、D、E可形成化合物Y。A、C、D可形成离子化合物Z。
回答下列问题:
⑴A元素为________________;E元素为____________________;
⑵Y的电子式: ;W分子的空间构型为 __ ;
⑶写出加热条件下X与足量的Y在溶液中反应的方程式
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com